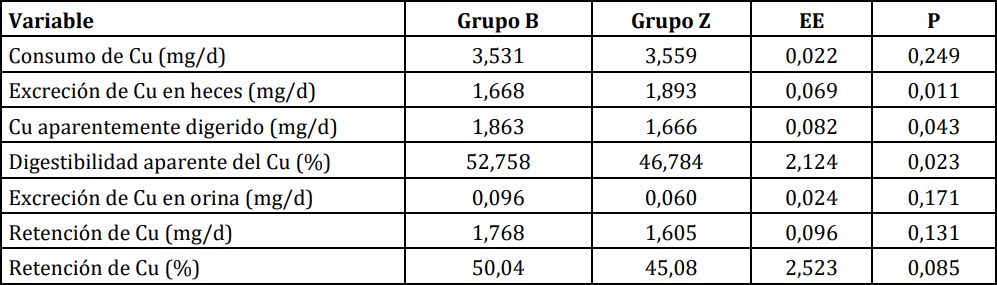
Tabla 1:: Balance de Cu en corderos alimentados con una dieta basal (B) o suplementados con 30 ppm de Zn (Z). Primer período.
ARTÍCULO DE INVESTIGACIÓN
Alimentación de corderos con una dieta deficiente en zinc: efecto sobre parámetros relacionados con la absorción y el metabolismo del cobre
Pechin, GH1; Genero, GA1; Cseh, SB2
1
Facultad de Ciencias Veterinarias, UNLPam, calle 5 y 116, (6360) General Pico, La Pampa.
2
INTA Balcarce.
Recibido: 22/06/2022
Aceptado: 19/09/2022
Correspondencia e-mail:Guillermo H. Pechin ghpechin@vet.unlpam.edu.ar
Resumen
El objetivo de este ensayo fue estudiar el efecto del consumo de una dieta deficiente en zinc (Zn) sobre los niveles plasmáticos, la concentración tisular y la retención de cobre (Cu) en ovinos. Diez corderos fueron asignados aleatoriamente a dos grupos: basal (B; 10 ppm de Zn) y suplementado con 30 ppm de Zn (Z). El ensayo se extendió por el término de 20 semanas, con sangrados cada 4 semanas. En las semanas 6 y 20 se evaluó el balance de Cu. Al final del trabajo, se realizó la eutanasia y se recogieron muestras de músculo, hígado, páncreas, testículo, riñón, pulmón, hueso y lana para determinar la concentración de Cu. Los niveles de Cu plasmático solo fueron más bajos en el grupo Z en la última medición. En el primer período de balance, la digestibilidad aparente del Cu fue menor en el grupo Z (46,78 %) que en el grupo B (52,76 %), mientras que la retención de Cu tuvo una tendencia similar. Sin embargo, en el segundo período de balance no se detectaron diferencias entre los grupos. La concentración de Cu en hígado y en lana fue menor en el grupo Z. El resto de las variables no difirieron entre tratamientos. Estos resultados sugieren que la deficiencia de Zn incrementa la absorción del Cu y su concentración en hígado y lana.
Palabras clave: deficiencia de zinc, corderos, cobre
Feeding lambs with a zinc-deficient diet: effect on parameters related to copper absorption and metabolism
Summary
The objective of this trial was to study the effect of a diet deficient in Zn on Cu plasma levels, tissue concentrations and mineral retention in lambs. Ten lambs were randomly assigned to two groups: basal (B; 10 ppm of Zn) and supplemented with 30 ppm of Zn (Z). The trial lasted for 20 weeks. Blood samples were collected every 4 weeks by jugular venipuncture. In weeks 6 and 20, Cu balance was evaluated. At the end of the trial, euthanasia was performed and samples of muscle, liver, pancreas, testis, kidney, lung, bone and wool were collected to determine the concentration of Cu. Plasma Cu levels were only lower in group Z in the last sampling. In the first balance period, the apparent digestibility of Cu was lower in group Z (46.78 %) than in group B (52.76 %), while Cu retention had a similar trend. However, in the second balance period, no differences were detected between the groups. The Cu concentration in liver and wool was lower in group Z. The rest of the variables did not differ between treatments. These results suggest that zinc deficiency increases Cu absorption and its concentration in liver and wool.
Key words: zinc deficiency, lambs, copper
INTRODUCCIÓN
Desde hace varias décadas se han reconocido los efectos del antagonismo del zinc (Zn)
sobre la absorción y el metabolismo del cobre
(Cu), tanto en el hombre como en los animales domésticos18. Ott et al.12,13 hallaron que la adición de
1.000 ppm de Zn como óxido de Zn (ZnO) en la
dieta de corderos en crecimiento produce disminución de la eficiencia de conversión alimenticia
y de los niveles de Cu en suero, y que la adición de
2.000 ppm de Zn, disminuye la ganancia de peso
y los depósitos de Cu en hígado. Aunque estos autores no hallaron efectos negativos con la adición
de 500 ppm de Zn, Saylor y Leach20 demostraron
que estos niveles pueden producir una disminución del Cu y de la actividad de la ceruloplasmina
en plasma cuando la concentración de Cu dietario
es relativamente baja. El límite máximo tolerable
de Zn en alimentos para ovinos ha sido fijado en
300 mg/kg MS10, unas diez veces el requerimiento11.
Sin embargo, no se ha establecido una máxima relación dietaria Zn/Cu, como se ha estudiado
para otros antagonistas del Cu, como el molibdeno
(Mo) y el hierro (Fe)21.
El Zn y el Cu se absorben en intestino delgado por mecanismos diferentes. La absorción del
Zn involucra a dos proteínas: Zip4 en membrana
apical y ZnT1 en membrana basolateral9
, mientras
que la absorción de Cu se realiza a través de los
transportadores CTR1 y, secundariamente, DMT1
en membrana apical y ATP7A en membrana basolateral4
. De esta manera, es improbable que la
interacción Zn-Cu se produzca a este nivel. La hipótesis dominante durante muchos años5
sostenía
que el alto consumo de Zn induce la síntesis de
metalotioneína (MT) en la mucosa intestinal, la
que se une al Cu y reduce su movimiento hacia la
circulación. Esta hipótesis fue confrontada posteriormente por Reeves17, que sugiere que la inducción de la MT intestinal puede ser una estrategia
de corto término para disminuir la absorción de
algunos metales, pero que otros mecanismos más
eficientes son puestos en marcha en exposiciones
de largo término. Por otro lado, debido a que los
ovinos son especialmente susceptibles a la intoxicación crónica con Cu3,21, el Zn se ha utilizado con
fines preventivos, ya que induce también la síntesis de MT en hígado y facilita así la secuestración
de Cu y su excreción biliar2
.
En animales de interés productivo y de
laboratorio, pocos ensayos han explorado las posibles interacciones entre Zn y Cu en el rango de
concentraciones más cercanas a las naturalmente
halladas en los alimentos, o bien, cuando los niveles de Zn son deficientes, lo que podría, en algún
grado, incrementar la absorción de Cu. El presente
trabajo es parte de un ensayo en el que se utilizó
un modelo de deficiencia de Zn, cuyos resultados
fueron publicados en forma parcial14,15 y que ha
demostrado producir una disminución de varios
parámetros, como la concentración de Zn en plasma y hueso, la retención de Zn y de nitrógeno y la
producción de lana en ovinos.
Los objetivos de este ensayo incluyeron
verificar el efecto del consumo de una dieta
deficiente en Zn en corderos sobre los niveles plasmáticos y tisulares de Cu y la retención del mineral.
MATERIALES Y MÉTODOS
Diez corderos de raza Corriedale, machos,
de 75 días de edad y con un peso de 10,09 ± 1,285
kg, fueron asignados en forma aleatoria a dos grupos, de acuerdo al nivel de Zn en la ración: basal
(B) y suplementado con Zn (Z). Ambos grupos
recibieron una dieta compuesta, en base materia
seca (MS), por: 30 % de paja de trigo, 34,8 % de almidón de maíz, 14 % de sacarosa, 10 % de albúmina de huevo deshidratada, 2 % de aceite de girasol,
2 % de urea y 4,2 % de núcleo mineral-vitamínico
sin Zn. La dieta B contenía 10 ppm de Zn, base MS,
y la dieta Z fue la misma, pero suplementada con
sulfato de zinc monohidratado (ZnSO4.H2O), a un
nivel extra de 30 ppm de Zn, para cumplir con las
recomendaciones del NRC11. Ambas dietas fueron
formuladas para alcanzar 10 ppm de Cu y contenían, en promedio, 0,20 % de azufre (S), 94 ppm
de Fe y 0,7 ppm de Mo. El alimento se administró
dos veces al día, por la mañana y por la tarde, en
forma restringida, a un nivel que fluctuó entre el
2,7 y el 3 % del peso de los animales.
El protocolo de manejo y de eutanasia de
los animales fue aprobado por el Comité de Ética
de la Facultad de Ciencias Veterinarias, UNLPam.
Los corderos fueron alojados en jaulas de plástico,
de 1 m x 0,5 m, con piso ranurado. El ensayo tuvo
una duración de 20 semanas. Al inicio del experimento, se esquiló un área de 80 cm2
del flanco de
cada cordero para obtener, al finalizar el ensayo,
una muestra de lana correspondiente al periodo experimental y medir la concentración de Cu.
Cada 4 semanas, se extrajo una muestra de sangre
de vena yugular, utilizándose heparina como anticoagulante. La muestra obtenida fue centrifugada
a 2.000 rpm, durante 10 minutos, y el plasma sobrenadante se separó para la posterior medición
de los niveles de Cu. En la sexta y la última semana
del trabajo se evaluaron la cantidad de Cu aparentemente digerido y el balance de Cu, de acuerdo a
las siguientes fórmulas (todo en mg/día):
Cu aparentemente digerido = Cu consumido –
Cu excretado en heces
Retención de Cu = Cu consumido – (Cu excretado
en heces + Cu excretado en orina)
Durante cada período de balance (5 días)
se midió el alimento consumido por cada animal
y la producción de heces y de orina, las que se
recogieron y pesaron diariamente. Se tomó una
alícuota diaria de cada excreta (30 g para heces y
20 ml para orina), las que se guardaron a -20 ⁰C
hasta su análisis.
Al finalizar el ensayo se realizó la eutanasia de los animales por exanguinación, previa anestesia con pentotal sódico. Se recogieron muestras
de músculo (longissimus dorsi, supraescapular y
semimembranoso), hígado, páncreas, testículo,
riñón, pulmón, hueso (metacarpo y metatarso) y
lana (de la porción esquilada al inicio del ensayo)
para la determinación de los niveles de Cu, por espectrofotometría de absorción atómica16.
Las muestras de tejidos blandos fueron
cortadas en trozos de 1 cm3
y secadas en estufa
de flujo continuo a 100 °C hasta peso constante.
Luego, se procedió al molido de las mismas y se
tomó una submuestra de 500 mg de cada tejido.
Cada submuestra fue sometida a una digestión ácida con una mezcla de 2 ml ácido nítrico (HNO3
,
68 % V/V), 2 ml de ácido sulfúrico (H2SO4, 98 %
V/V) y 2 ml de ácido perclórico (HClO4, 70 % V/V).
Una vez terminado el proceso de digestión se llevó
a un volumen de 25 ml, utilizando agua deionizada.
Las muestras de alimento y heces fueron
secadas a 100 °C y molidas en un molino a martillo
tipo Resch. Luego de obtener una submuestra de
500 mg de cada una, se procedió de acuerdo a lo
descripto para tejidos blandos.
Las muestras de hueso fueron desengrasadas con acetona, durante 48 h, enjuagadas con
agua deionizada y llevadas a una mufla a 500 °C,
durante 5 h. De las cenizas obtenidas, se pesaron
500 mg y se procedió a tratamiento ácido y dilución como se describió previamente.
Las muestras de lana fueron lavadas con
una solución de agua bidestilada y detergente
neutro. Luego de enjuagadas repetidas veces con
agua deionizada, fueron secadas a 60 °C. Una submuestra de 500 mg de cada una fue
sometida a digestión ácida y dilución, para su posterior análisis.
Análisis estadístico
Los datos fueron analizados en un diseño completamente aleatorio. Para la variable concentración de Cu en plasma se utilizó un modelo mixto con mediciones repetidas en el tiempo (PROC MIXED, SAS/STAT 9.1)8,19. El modelo incluyó los efectos fijos de tratamiento, tiempo e interacción tratamiento x tiempo, el efecto aleatorio del animal dentro de tratamiento y el error experimental. Se usó una estructura de covarianza autorregresiva de orden 1 para varianzas homogéneas (AR1). Para el resto de las variables (concentración tisular y balance de Cu) se utilizó el procedimiento PROC GLM, del mismo paquete estadístico, con un modelo que incluyó el efecto fijo de tratamiento y el error experimental.
RESULTADOS
a. Primer período de balance.
Por diseño, el consumo de Cu no difirió entre grupos (P=0,249). Aunque las diferencias numéricas
no fueron grandes (52,8 % vs 46,8 %), hubo un
efecto estadísticamente significativo (P<0,05) de la
adición de Zn sobre la digestibilidad aparente del
Cu (Tabla 1), mientras que la retención porcentual
de Cu tendió (P<0,10) a ser menor en el grupo Z.
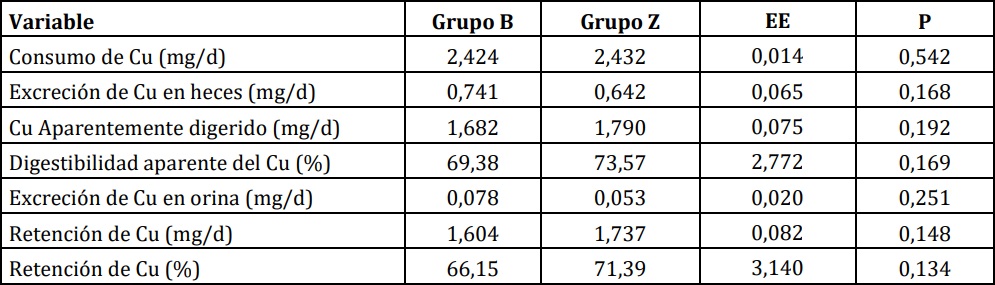
b. Segundo período de balance.
Como se observa en la Tabla 2, los efectos sobre
la retención de Cu no se repitieron en el segundo
ensayo de balance.
Tabla 1:: Balance de Cu en corderos alimentados con una dieta basal (B) o suplementados con 30 ppm de Zn (Z).
Primer período.

Tabla 2:: Balance de Cu en corderos alimentados con una dieta basal (B) o suplementados con 30 ppm de Zn (Z).
Segundo período.
c. Niveles de Cu en plasma. De acuerdo a la interacción Tratamiento x Tiempo (P<0,10) graficada en la Figura 1, los niveles de Cu plasmático solo fueron afectados por la suplementación con Zn en la última medición (P<0,01), en la que los grupos B y Z presentaron valores de 0,88 y 0,54 mg/l, respectivamente.
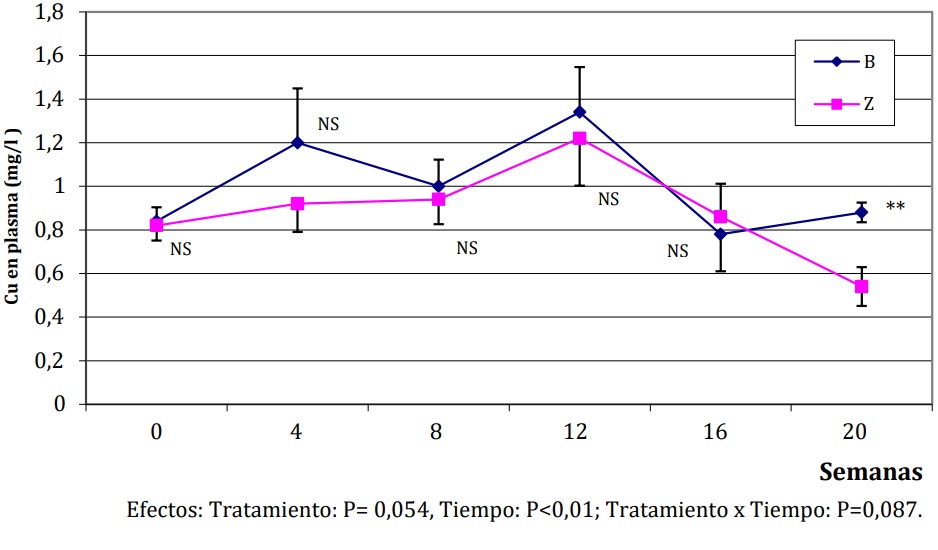
Figura 1:Medias (± DE) de la evolución del Cu plasmático en corderos alimentados con una dieta basal (B) o
suplementados con 30 ppm de Zn (Z).
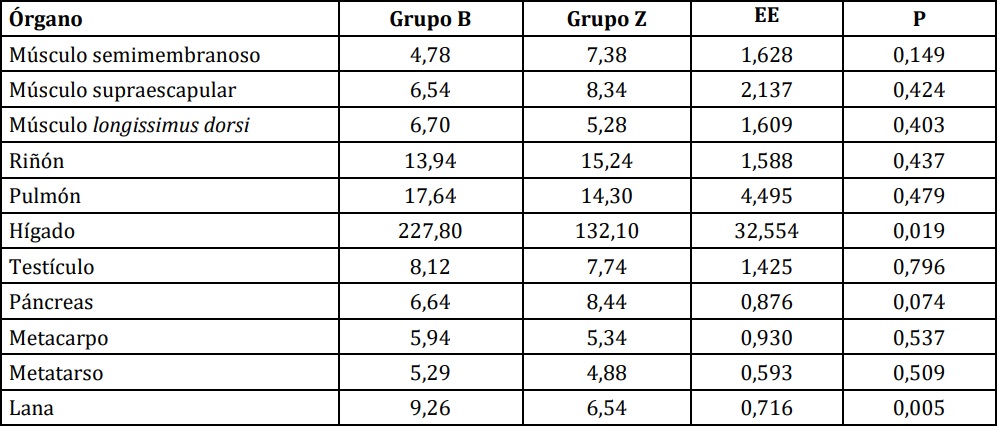
d. Concentración de Cu en órganos Como se observa en la Tabla 3, el grupo B presentó mayor concentración de Cu en hígado (P<0,05) y en lana (P<0,01), con una tendencia en sentido inverso en páncreas.
Tabla 3:Concentración de Cu en órganos (mg/kg MS) de corderos alimentados con una dieta basal (B) o suplementados con 30 ppm de Zn (Z).
DISCUSIÓN
En nuestro trabajo, en el primer período
de balance, la suplementación con Zn disminuyó
la absorción aparente de Cu y tendió a disminuir la
retención del mismo. Este efecto antagónico, aunque pequeño, contrasta con lo hallado en situaciones de alimentación pastoril, en las que son más
importantes otros antagonistas del Cu (Mo, Fe y
S)21. Sin embargo, estos resultados no pudieron
ser corroborados en el segundo ensayo de balance. En otro trabajo similar, una suplementación de
30 ppm de Zn, en corderos alimentados con una
dieta a base de forrajes que contenían entre 15 y
23 ppm de Zn, no modificó los niveles de Cu plasmático, la absorción aparente de Cu ni la retención
de Cu, pero este ensayo fue de una duración relativamente corta (42 días)7
. En un ensayo de 150
días6
, la adición de una cantidad moderada de Zn
(20 ppm) no tuvo efecto sobre el Cu sérico ni el
balance de Cu. Sin embargo, la dieta del grupo
control contenía 34 ppm de Zn, cantidad que cubre los requerimientos de Zn, de acuerdo al NRC11.
Aliarabi et al.1
tampoco encontraron efectos de la
suplementación con 40 ppm de Zn en corderos
sobre Cu plasmático, absorción aparente de Cu y
retención de Cu, en un estudio en el que la dieta
control contenía 22,5 ppm de Zn.
La menor concentración de Cu plasmático
en el grupo Z con respecto al B en la última medición, sumado a la menor concentración del mineral en lana,
podría suponer el efecto de una depleción progresiva de las reservas hepáticas de Cu,
asociado con los menores niveles de Cu en hígado
hallados al finalizar el ensayo en el grupo Z. Sin
embargo, de acuerdo a la bibliografía21, la concentración de Cu en hígado está por encima de la indicativa de una deficiencia del mineral y no debería
haberse reflejado, por lo tanto, en un descenso de
la cupremia. En este sentido, sería de interés explorar en futuros experimentos si el nivel de Cu
hepático para sostener una cupremia normal es
más elevado en ovinos en crecimiento.
A pesar de que existen trabajos que fallaron en demostrar una interacción Zn x Cu en ovinos, todos ellos utilizaron dietas basales con niveles mayores a los usados en nuestro estudio. En un
ensayo similar al nuestro22, la adición de Zn a una
dieta basal que contenía 4 ppm de Zn disminuyó
linealmente la concentración de Cu en lana. Sin
embargo, estos autores no midieron Cu hepático o
sérico. La discrepancia entre los resultados alcanzados en los ensayos con ovinos puede obedecer,
al menos en parte, a la concentración de Zn en la
dieta basal contra la que se realizan las comparaciones. Es probable, entonces, que sean necesarios
niveles de 4 a 10 ppm de Zn (un rango de deficiencia dietaria del mineral) para producir mejoras
en la eficiencia de absorción del Cu. En qué grado
este aumento en la absorción puede predisponer a
una intoxicación crónica con Cu es un aspecto que
amerita ser indagado. Contrariamente, una suplementación moderada de Zn por encima de niveles
cercanos a los requerimientos (20 a 30 ppm de
Zn) no parece producir efectos significativos sobre la absorción del Cu.
CONCLUSIONES
Tomados en su conjunto, los resultados de este ensayo indican que la deficiencia de Zn en ovinos puede mejorar la absorción del Cu e incrementar su concentración en hígado y lana, aunque resta profundizar acerca de su relevancia biológica y productiva.
1. Aliarabi, H.; Fadayivar, A.; Tabatabei, M.M.; Zamani, P.;
Bahari, A.; Farahavar, A.; Dezfoulian, A.H. Effect of zinc
source on hematological, metabolic parameters and
mineral balance in lambs. Biol Trace Elem Res. 2015;
168:82-90.
2. Bremner, I. Nutritional and physiological significance of
metallothionein. Methods Enzymol. 1991; 205:25-35.
3. Bremner, I. Manifestations of copper excess. Am J Clin
Nutr. 1998: 67(Suppl.):1069S-73S.
4. Doguer, C.; Ha, J-H.; Collins, J.F. Intersection of iron and
copper metabolism in the mammalian intestine and liver.
Compr Physiol. 2018; 8:1433-61.
5. Fischer, P.W.F.; Firoux, A.; L’Abbé, M.R. Effects of zinc on
mucosal copper binding and on the kinetics of copper
absorption. J Nutr. 1983:462-69.
6. Garg, A.K.; Mudgal, V.; Dass, R.S. Effect of organic zinc
supplementation on growth, nutrient utilization and
mineral profile in lambs. Anim Feed Sci Technol. 2008;
144:82-96.
7. Kegley, E.B.; Spears, J.W. Effect of zinc supplementation
on performance and zinc metabolism of lambs fed foragebased diets. J Agric Sci. (Cambridge). 1994; 123:287-92.
8. Littell, R.C.; Henry, P.R.; Ammermann, C.B. Statistical
analysis of repeated measures data using SAS procedures.
J Anim Sci. 1998; 76:1216-31.
9. Maares, M.; Haase, H. A guide to human zinc absorption:
General overview and recent advances of in vitro
intestinal models. Nutrients. 2020; 12:762; doi:10.3390/
nu12030762.
10. National Research Council. Mineral tolerance of animals.
2005. 2nd Revised Edition. National Academies Press,
Washington, D.C., USA.
11. National Research Council. Nutrient Requirements of
Small Ruminants. 2007. National Academies Press,
Washington, D.C., USA.
12. Ott, E.A; Smith, W.H.; Harrington, R.B.; Beeson, W.M. Zinc
toxicity in ruminants. I. Effects of high levels of dietary
zinc on gains, feed consumption and feed efficiency of
lambs. J Anim Sci. 1966; 25:414-18.
13. Ott, E.A; Smith, W.H.; Harrington, R.B.; Stob, M.; Parker,
H.E.; Beeson, W.M. Zin toxicity in ruminants. III.
Physiological changes in tissues and alterations in rumen
metabolism in lambs. J Anim Sci. 1966; 25:424-31.
14. Pechin, G.H.; Corbellini, C.N.; Cseh, S.B.: Stritzler, N.P.
Efectos de la deficiencia subclínica de zinc en corderos
sobre parámetros bioquímicos, concentración tisular y
balance de zinc. InVet. 2018; 20:243-54.
15. Pechin, G.H.; Corbellini, C.N.; Denda, S.S. Efecto de la
deficiencia subclínica de zinc en corderos sobre la
retención de nitrógeno, parámetros productivos y
hematológicos. Cienc Vet. 2021; 23:119-34.
16. Perkin Elmer. Analytical methods for atomic absorption
spectroscopy. The PerkinElmer Corporation (Ed.).
Branford, USA, 1996.
17. Reeves, P.G. Adaptation responses in rats to long-term
feeding of high-zinc diets: emphasis on intestinal
metallothionein. J Nutr Biochem. 1995; 6:48-54.
18. Sandstead, H.H. Requirements and toxicity of essential
trace elements, illustrated by zinc and copper. Am J Clin
Nutr. 1995; 61(Suppl.):621S-4S.
19. SAS Institute Inc. SAS/STAT 9.1 User’s Guide. 2004. Cary,
NC, USA.
20. Saylor, W.W.; Leach Jr, R.M. Intracellular distribution of
copper and zinc in sheep: Effect of age and dietary levels
of minerals. J Nutr. 1980; 110:448-59.
21. Suttle, N.F. Mineral nutrition of Livestock. Fourth Edition.
CAB International. Wallingford. UK. 2010.
22. White, C.L.; Martin, G.B.; Hynd, P.I.; Chapman, R.E. The
effect of zinc deficiency on wool growth and skin and
wool follicle histology of male Merino lambs. Br J Nutr.
1994; 71:425-35.