ARTÍCULO DE INVESTIGACIÓN
Efecto del estrés crónico sobre la inmunolocalización del
factor de crecimiento del endotelio vascular en la corteza
adrenal de ratas gestantes
Flores Bracamonte, MC1; Cots, D1; Bellingeri, R2; Bozzo, A2.
1
Instituto de Ciencias Veterinarias (INCIVET) CONICET, Universidad Nacional de Río Cuarto, Ruta 36 Km 601, Córdoba, 5800,
Argentina.
2
Instituto de Investigaciones en Tecnologías Energéticas y Materiales Avanzados (IITEMA) CONICET, Universidad
Nacional de Río Cuarto, Ruta 36 Km 601, Río Cuarto, Córdoba, 5800, Argentina.
Recibido:13/05/22
Aceptado:18/08/22
Correspondencia e-mail:Andrea Bozzo abozzo@ayv.unrc.edu.ar
Resumen
El estrés crónico durante la gestación puede alterar la morfología de la corteza adrenal y su vasculatura. El
factor de crecimiento del endotelio vascular (VEGF) interviene en la vascularización y en la angiogénesis.
El objetivo de este trabajo fue evaluar los efectos del estrés crónico materno sobre los niveles plasmáticos
de corticosterona y sobre la distribución de la inmunomarcación de VEGF en la corteza adrenal de ratas
gestantes. El estrés por inmovilización fue aplicado desde el cuarto día de la gestación hasta el sacrificio
a los 12, 17 y 21 días de la gestación. Se emplearon técnicas de radioinmunoanálisis, inmunomarcación
y recuentos celulares. En las ratas estresadas gestantes se observó un incremento significativo (p<0,05)
en los niveles plasmáticos de corticosterona en todos los momentos estudiados. La inmunolocalización
evidenció, en la corteza adrenal, marcación para VEGF en la zona fascicular y en la zona semejante a
reticular, pero no en la zona glomerular. Se identificó una disminución significativa de la marcación
con VEGF a los 17 días de gestación en el grupo estrés (p<0,05). Estos resultados demuestran que la
inmovilización es un estímulo estresor intenso y que los glucocorticoides producidos podrían disminuir
la síntesis de VEGF.
Palabras clave:corticosterona, inmovilización, gestación, angiogénesis
Effect of chronic stress on the immunolocalization of vascular endothelial growth
factor in the adrenal cortex of pregnant rats
ABSTRACT
Chronic stress during pregnancy can alter the adrenal cortex morphology and its vasculature.
Vascular endothelial growth factor (VEGF) is involved in vascularization and angiogenesis. The objective
of this study was to evaluate the effects of maternal chronic stress on plasma corticosterone levels and
on the distribution of VEGF immunostaining in the adrenal cortex of pregnant rats. Immobilization
stress was applied from the fourth day of gestation until sacrifice at 12, 17 and 21 days of gestation.
Radioimmunoassay, immunolabeling and cell count techniques were used. In stressed pregnant rats,
a significant increase (p<0.05) in plasma corticosterone levels was observed at all gestation times
analyzed. Immunolocalization revealed VEGF in the fascicular and in the reticular-like zone, but not in
the glomerular zone of the adrenal cortex. A significant decrease in the VEGF labeling was identified at
day 17 of gestation in the stressed group (p<0.05). These results demonstrate that the immobilization is
an intense stressor stimulus and that the glucocorticoids produced could decrease the VEGF synthesis.
Key words:corticosterone, inmobilization, gestation, angiogénesis
INTRODUCCIÓN
El desarrollo vascular es un requisito
fundamental para el crecimiento y funcionalidad de
los tejidos y su homeostasis depende del equilibrio
entre los procesos de apoptosis y proliferación
celular25. La glándula adrenal está constituida
por una cápsula mesenquimatosa externa, debajo
de la cual se encuentra la corteza y la médula. La
corteza adrenal adulta está muy vascularizada,
produce hormonas esteroideas y presenta tres
zonas concéntricas30: la zona glomerular (zG) que
secreta mineralocorticoides cuya función principal
es regular el volumen intravascular a través de
la retención de sodio y, por lo tanto, controla la
presión arterial; la zona fascicular (zF) que produce
glucocorticoides (GC) que tienen diversos efectos
sobre la inmunidad, el metabolismo, el desarrollo,
el comportamiento y la respuesta a situaciones de
estrés. Por último, la más interna, la zona reticular
(zR) que sintetiza los andrógenos. Si bien las ratas
y ratones carecen de una verdadera zR18, sobre la
base de estudios recientes se ha evidenciado que, en
estos roedores, la zF es heterogénea y contiene una
subpoblación celular que puede compartir algunas
similitudes con la zR, por lo que es denominada
zona semejante a la reticular (zlR)11, 21. La corteza
adrenal está sometida a remodelaciones celulares
que pueden ser explicadas por diferentes teorías. En
la actualidad la teoría de la proliferación/migración
de las células progenitoras es la más aceptada
y propone que todas las células de la corteza
adrenal podrían tener un origen común que se
vuelve funcionalmente diferenciado (zonificación
histológica) con el apropiado entorno de la zona.
Las células progenitoras proliferan en las capas
periféricas de la glándula y posteriormente migran,
efectuando una repoblación celular centrípeta29.
La definición biológica de estrés refiere
a un estado de homeostasis amenazada que
es contrarrestado por un complejo repertorio
de respuestas conductuales y fisiológicas
para restablecerlo9
. En general las situaciones
de estrés son acompañadas por cambios de
comportamiento, neuroquímicos, inmunológicos,
endocrinos y metabólicos que tienen como
objetivo fundamental asegurar la capacidad para
desarrollar un comportamiento activo, al tiempo
que inhiben los procesos anabólicos como la
ingesta, el crecimiento y la reproducción3, 22. La
activación de estos cambios es coordinada por el
eje hipotálamo-hipofisario-adrenal (HHA) con la
secreción hipotalámica de la hormona liberadora
de corticotrofina (CRH) y la consecuente liberación
de la hormona adrenocorticotrófica (ACTH) desde
la hipófisis que induce la producción de GC en la
corteza adrenal22. El incremento de los niveles
plasmáticos de GC produce una retroalimentación
negativa de la ACTH a nivel del hipotálamo y la
adenohipófisis20. De esta manera, la glándula adrenal responde continuamente a estímulos
repetidos y transitorios generados por el estrés
que pueden afectar períodos como la gestación y
desencadenar trastornos de ansiedad, depresión,
déficits de atención y desbalances hormonales,
muchos de los cuales están asociados con
alteraciones del eje HHA. Por esta razón, varios
modelos animales de estrés son utilizados en
estudios de desórdenes psiquiátricos3, 22.
Cuando las condiciones estresantes son
frecuentes o prolongadas, la corteza adrenal tiene
la capacidad de adoptar una identidad funcional
en respuesta a las señales del medio hormonal
y el microambiente celular para mantener su
homeostasis. Esto incluye procesos como la
proliferación, la apoptosis y la expansión zonal y
la diferenciación zonal29.
Los efectos de las situaciones estresantes
durante la gestación están en relación con la
naturaleza del estímulo, su intensidad, duración de
la exposición y los eventos que se producen en los
compartimientos maternos y fetales5
. Cuando se
aplica un estrés crónico intermitente de intensidad
suficiente como la inmovilización, la glándula
adrenal responde con un aumento de su tamaño
que se acompaña de un incremento máximo en
los niveles plasmáticos de corticosterona (CORT)
como respuesta al efecto trófico de la ACTH16.
Originalmente, se consideró que la ACTH tenía un
efecto antiproliferativo en la adrenal, aunque en
los últimos años se ha descrito que podría tener
un efecto inductor de la proliferación actuando
por medio de factores de crecimiento, como el
factor de crecimiento el endotelio vascular (VEGF),
que es el principal factor que interviene en la
vascularización de los tejidos. El VEGF participa
en la inducción de la angiogénesis mediante
la proliferación de las células endoteliales y el
aumento de la permeabilidad vascular25. Algunos
autores observaron la presencia de VEGF en
la corteza adrenal de ratas y evidenciaron que
la ACTH estimula su síntesis y promueve la
neovascularización adrenocortical24, 27. En cultivos
de células bovinas la ACTH indujo un rápido
aumento en la expresión de VEGF13. Sin embargo,
el efecto de los GC sobre la expresión de VEGF en
ratones es contradictorio. Resultados obtenidos en
células pulmonares no evidenciaron variaciones
en la expresión de VEGF2
, mientras que otros
estudios realizados in vitro revelaron que la
dexametasona inhibe la inducción de VEGF23.
Estudios previos han demostrado que
las características estereológicas de la glándula
adrenal en ratas pueden verse afectadas por la
exposición al estrés y por otras experiencias
adversas que podrían alterar ciertos parámetros
morfológicos y fisiológicos característicos de esta
glándula28. Sin embargo, existe poca información
sobre la relación entre el estrés durante la
gestación, la estructura y la vascularización
adrenocortical. Debido a esto, el objetivo de este
trabajo fue evaluar los efectos del estrés crónico
materno sobre los niveles plasmáticos de CORT y
sobre la distribución de la inmunomarcación de
VEGF en la corteza adrenal de ratas gestantes.
MATERIALES Y MÉTODOS
Animales y condiciones de laboratorio
Los animales utilizados fueron obtenidos
del bioterio del Departamento de Biología
Molecular de la Facultad de Ciencias Exactas,
Físico-Químicas y Naturales de la Universidad
Nacional de Río Cuarto (UNRC). Se utilizaron
30 ratas hembras albinas primíparas de la cepa
Wistar, de 90 a 120 días de edad con un peso
corporal inicial de 200 a 300 gramos. Fueron
alojadas de a cuatro individuos por jaula en
condiciones estándares de bioterio: temperatura
de 22 ± 2 °C, fotoperiodo controlado con 12 horas
de luz, humedad ambiente y con administración
de alimento y agua “ad-libitum”. Las instalaciones
cumplen con los requisitos de la disposición
N° 6344/96 de la Administración Nacional de
Medicamentos, Alimentos y Tecnología Médica,
Argentina. El ciclo estral fue analizado por medio
de colpocitogramas en fresco, al determinar el
proestro se mantuvieron por el término de 12
a 18 horas con un macho de la misma cepa. Al
día siguiente, se constató en el fluido vaginal la
presencia de espermatozoides para determinar
el día cero de la preñez a los fines del sacrificio
programado. Todos los procedimientos se
realizaron con la aprobación del Comité Ético
de Investigación en animales de la Universidad
Nacional de Río Cuarto (CoEdI), Res. 186/2016.
Diseño experimental
Las hembras gestantes se separaron en
dos grupos: control (C) y experimental (E). Las hembras del grupo C permanecieron en sus jaulas
hasta el momento del sacrificio. A las ratas del
grupo E se les aplicaron sesiones de estrés por
restricción de movimientos en un cepo tubular
de plástico perforado, adaptado para ratas. El
tratamiento se aplicó a partir del cuarto día de
la gestación, hasta el día previo del sacrificio,
bajo normas éticas para manejo de animales
de experimentación. Se utilizó un modelo
estandarizado de restricción de movimiento
para inducir estrés en ratas gestantes7
. Para la
inducción del estrés, las ratas fueron trasladadas
a una habitación independiente del bioterio. Con
una frecuencia de día por medio se introdujo a
cada una de las hembras gestantes dentro de un
recipiente cilíndrico de tereftalato de polietileno
(7 cm de diámetro y 19 cm de largo) durante
45 minutos. Después del periodo de restricción
de movimientos las hembras fueron regresadas
a su jaula. Para minimizar la variabilidad en el
desarrollo de los procedimientos, todos fueron
realizados por un solo experimentador. Se trabajó
con un total de 30 animales, 5 para cada grupo y
edad gestacional.
Sacrificio, toma y procesado de las muestras
Las ratas de ambos grupos fueron
sacrificadas a los 12, 17 y 21 días de la gestación
por decapitación, sin aplicación de anestésicos ya
que el éter, compuestos de amonio, barbitúricos
y otros anestésicos provocan alteraciones en SNC
actuando como estresores12. Inmediatamente
después del sacrificio, se recolectaron muestras
de sangre en tubos con heparina (200-300 μl) de
ratas del grupo C y E, de todos los días de gestación
estudiados. Las muestras fueron centrifugadas
a 3000 rpm por 3 min a 15 °C. Luego, la fracción
plasmática fue removida y almacenada a -20 °C
para el análisis de CORT.
Para la inmunolocalización de VEGF se
extrajeron las glándulas adrenales, se fijaron en
formol tamponado al 10 % durante 12 horas y se
procesaron de acuerdo a la técnica de microscopía
óptica convencional. Se obtuvieron cortes seriados
de 4 μm de la corteza adrenal con un micrótomo
(Reichert-Jung Biocut 2035) y el montaje en
portaobjetos con adhesivo (Vectabond). Se
procesaron tres muestras por animal; teniendo
cada uno dos cortes de la misma glándula, pero a
distinto nivel de la corteza adrenal.
Determinación de los niveles de
corticosterona plasmática
Los niveles plasmáticos de CORT fueron
medidos por radioinmunoensayo (RIA) utilizando
un antisuero de conejo altamente específico para
CORT (Bioclin, Cardiff, UK) y un patrón de CORT
(4-pregnenolona-11,21-diol-3,20 diona, Sigma,
Boston, MA, USA). La sensibilidad del ensayo fue
de 10 pg de CORT y los coeficientes de variabilidad
inter e intra ensayo fueron <10 %.
Inmunolocalización de VEGF en la corteza
adrenal
Para la detección de VEGF, los cortes
histológicos fueron desparafinados en xilol
y rehidratados. La actividad de la peroxidasa
endógena fue bloqueada incubando los
portaobjetos en peróxido de hidrógeno al 30
% durante 30 min. El bloqueo de anticuerpos
inespecíficos se realizó con suero de caballo al 1 %
durante 1 hora a temperatura ambiente. Se incubó
durante 24 horas en cámara húmeda a 4 °C con el
anticuerpo primario anti-VEGF de ratón hecho en
conejo (diluido 1/200, AAM51, Biorad) y se utilizó
un anticuerpo secundario biotinilado durante 30
min en cámara húmeda a temperatura ambiente
(Vectastain ABC Elite Kit 6200, Vector Lab).
Posteriormente se incubó con el complejo avidina
peroxidasa por 30 minutos en cámara húmeda a
temperatura ambiente (Vectastain ABC Elite Kit
6200, Vector Lab). Para el control negativo, el
anticuerpo primario fue reemplazado con solución
salina tamponada con fosfato (PBS) y como
control positivo se utilizaron cortes de tejido de
tumor mamario. Se reveló con Diaminobenzidina
(DAB, Dako) durante 2 minutos. Finalmente,
se contrastó con hematoxilina de Mayer (Dako,
USA), se deshidrató con una batería de alcoholes
de graduación creciente y se realizó el montaje
definitivo con Depex.
Análisis de la inmunomarcación de VEFG en la
corteza adrenal
Las muestras inmunomarcadas para
la localización de VEGF, fueron observados con
un microscopio óptico Axiophot (Carl Zeiss),
adquiriendo las imágenes en un aumento de 400X
con una cámara digital Powershot G6, 7.1 mega-pixels (Canon INC, Japón) adosada al microscopio
a través de la utilización del Software Axiovision
Release 4.6.3 (Zeiss, Alemania). Se realizó un
recorrido a lo largo de la corteza adrenal evitando
la superposición de regiones del objeto de estudio.
Se obtuvieron de 10 a 12 imágenes de cada corte
histológico para abarcar la extensión de las
distintas zonas de la corteza adrenal. En cada una
de las imágenes, se cuantificó el número total de
células inmunomarcadas (positivas) y el número
total de células no inmunomarcadas (negativas)
diferenciando las zonas de la corteza mediante el
software Image J (obtenido de http://imagej.net).
Se determinó el Índice de VEGF (IVEGF) de cada
zona como el cociente entre células positivas para
VEGF y células totales (positivas + negativas) y se
multiplicó por 100.
Análisis estadístico
Los datos obtenidos verificaron las
pruebas de normalidad y homogeneidad de la
varianza. Para la comparación de medias entre
los grupos se utilizó el análisis de la varianza
(ANOVA) utilizando el software INFOSTAT10.
Se consideraron diferencias estadísticamente
significativas con un valor de p<0,05.
RESULTADOS
Niveles plasmáticos de corticosterona
Los resultados obtenidos mediante la técnica
de RIA, demuestran un incremento significativo
(p<0,05) de los niveles plasmáticos de CORT en el
grupo E con respecto al grupo C, en todos los estadios
gestacionales estudiados (Tabla 1).
Los datos son expresados como media ± desvío estándar. Las diferencias estadísticamente significativas entre el grupo
control y estresado se muestran con asteriscos (*p <0,05).
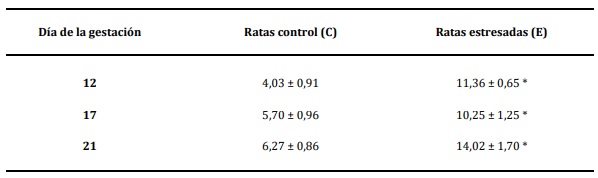
Tabla 1.Efecto del estrés por inmovilización en los niveles plasmáticos de corticosterona en ratas gestantes.
Inmunolocalización del VEGF
El análisis inmunohistoquímico de las
secciones de glándula adrenal permitió identificar
cualitativamente la localización del VEGF asociada
a células esteroidogénicas presentes en la zF
y zlR de la corteza adrenal, mientras que no se
detectó inmunomarcación en la zG. Este patrón de
inmumarcación se evidenció en todos los estadios
de la gestación analizados de los grupos C y E
(Figura 1).También se detectó la inmunomarcación
asociada a la red de capilares (Figura 2 y 3).
Índice de inmunomarcación del VEGF en la
corteza adrenal
El análisis estadístico del índice de VEGF
(IVEGF) evidenció una disminución significativa del
I
VEGF total en el día 17 en el grupo E con respecto
al grupo C (p=0,04), mientras que los días 12 y 21
no presentaron diferencias significativas entre los
grupos estudiados (Figura 1 y 4).
Se realizó un análisis individualizado de
la marcación de VEGF para cada zona de la corteza
adrenal. Luego del mismo, sólo se evidenció en
el día 17 una disminución significativa (p<0,05)
del IVEGF en la zlR del grupo E con respecto al
grupo C. Por su parte, en la zF no se observaron
diferencias estadísticamente significativas entre
el IVEGF de ambos grupos (Figura 1y 5).
DISCUSIÓN
En situaciones fisiológicas, la activación
del eje HHA en ratas culmina con la liberación de
CORT que ejerciendo una fuerte retroalimentación negativa sobre el núcleo paraventricular del
hipotálamo, la hipófisis y áreas del hipocampo
para inhibir la liberación inicial de hormonas14.
En este trabajo se pudo comprobar un incremento
sostenido en los niveles plasmáticos de CORT en
el grupo E en todos los estadíos gestacionales
estudiados. Algunos autores sugieren que los
niveles incrementados de CORT podrían ser
causados por una disminución de los receptores de
mineralocorticoides presentes en el hipocampo,
alterando los mecanismos de retroalimentación
del eje HHA26.
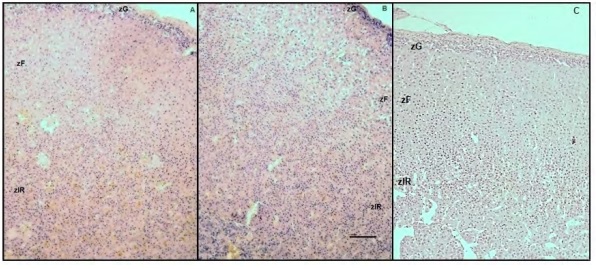
Figura 1.Localización inmunohistoquímica de VEGF en la corteza adrenal de ratas gestantes de 17 días de gestación.
(A) Grupo control (B) Grupo estrés (C) Control negativo. Barra de escala = 100 μm. Magnificación 100X. zG: zona
glomerular; zF: zona fascicular; zlR: zona semejante a la reticular.
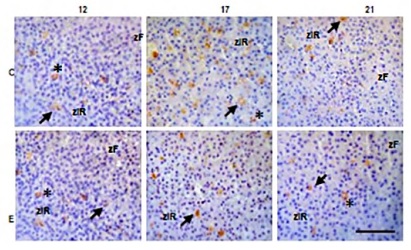
Figura 2.Localización inmunohistoquímica de VEGF en la corteza adrenal de ratas gestantes de 12, 17 y 21 días de gestación.
(C) Grupo control (E) Grupo estrés. Barra de escala = 50 µm. Magnificación 400X. zF: zona fascicular; zlR: zona semejante a la
reticular. Las flechas indican células esteroidogénicas y los asteriscos capilares sanguíneos positivos para VEGF.
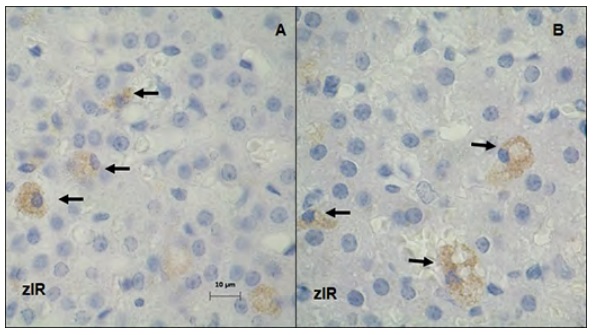
Figura 3.Localización inmunohistoquímica de VEGF en la corteza adrenal de ratas gestantes de 17 días de gestación.
(A) Grupo control (B) Grupo estrés. Barra de escala = 10 µm. Magnificación 1000X. zlR: zona semejante a la reticular.
Las flechas indican células esteroidogenicas positivas para VEGF.
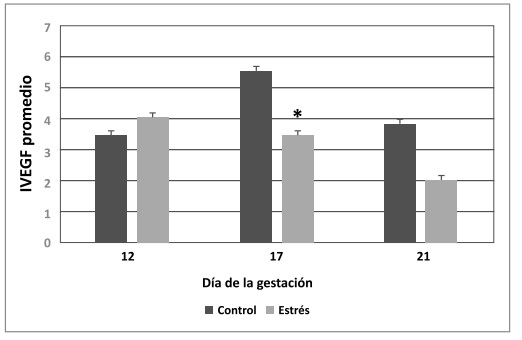
Figura 4.Índice de VEGF (IVEGF) promedio en la corteza adrenal de ratas gestantes de 12, 17 y 21 días de gestación.
La coloración gris oscura indica el grupo control y la gris clara el grupo estrés. Los datos son expresados como media
± error estándar. Las diferencias estadísticamente significativas entre el grupo control y estresado se muestran con
asteriscos (*p<0,05).
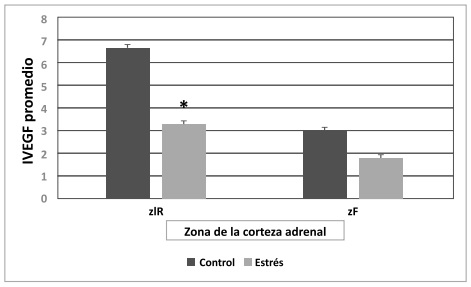
Figura 5. Índice de VEGF (IVEGF) según las zonas de la corteza adrenal en el día 17 de gestación. La coloración gris
oscura indica el grupo control y la gris clara el grupo estrés. Los datos son expresados como media ± error estándar.
Las diferencias estadísticamente significativas entre el grupo control y estresado se muestran con asteriscos (*p <0,05).
La exposición a modelos de estrés crónico
como la inmovilización es acompañada por una
fuerte respuesta del eje HHA con progresivos
retornos a la normalidad de los niveles
plasmáticos de la ACTH a pesar de la persistencia
de la exposición del estresor, mientras que bajo
las mismas condiciones, la CORT se mantiene
elevada. La causa de la disociación entre la CORT
y la ACTH no es conocida, pero hallazgos similares
se encuentran después de la aplicación del mismo
estresor en forma crónica intermitente20,26, como
sucede en nuestro modelo experimental.
La glándula adrenal es uno de los
órganos más vascularizados de los mamíferos
adultos y bajo la regulación de la ACTH, la corteza
adrenal expresa altos niveles de VEGF para el
mantenimiento de su densa vasculatura24, 27.
Estudios realizados en cultivo primario de células
fasciculares bovinas permitieron evidenciar que,
si bien la ACTH estimula la expresión de VEGF, su
concentración declina rápidamente debido a la
baja estabilidad de su ARNm8
. De acuerdo a estos
datos, el VEGF sería expresado bajo condiciones
fisiológicas y una inducción transitoria de ACTH,
como la generada por el estrés, podría tener una
influencia rápida pero poco estable en la expresión
de VEGF. Por otro lado, Thomas et al.
27 estudiaron
el efecto de la dexametasona aplicada durante 14
días en ratas para mimetizar las condiciones de
estrés crónico. Se evidenció un marcado descenso
de la ACTH plasmática en las primeras 24 horas
acompañado por la disminución progresiva de la
expresión del VEGF durante los primeros 4 días.
Posteriormente, la disminución de la red vascular
y la expresión del VEGF fue más acentuada. Por
lo tanto, la regresión vascular sería causada por
la disminución de la expresión del VEGF como un
efecto secundario a la privación de la ACTH.
En este trabajo se observó que el estrés
crónico produjo una disminución del IVEGF en el día
17 de la gestación, sin embargo, en el día 21 no
se encontraron diferencias significativas, aunque
las concentraciones de CORT se mantuvieron
elevadas. Esto está en relación con la disminución
sustancial en la respuesta del eje HHA tanto
a estresores físicos como psicológicos que se
presentan en la gestación tardía de la rata6
. Esta
adaptación es considerada fundamental para
proteger al feto de los efectos del estrés y en la
madre para garantizar la conducta motriz propia
del trabajo de parto, minimizando así el riesgo
de la programación perjudicial de los GC15. Esto podría ser explicado por el enmascaramiento de
los receptores de GC en respuesta al incremento
sostenido de la CORT durante la gestación tardía
en el grupo E20.
Es conocido que la ACTH estimula la
síntesis de VEGF en las células de la zF y la zR
(zlR en ratas) luego de la administración de
dexametasona17. En este trabajo, el análisis
inmunohistoquímico de VEGF realizado en los días
12, 17 y 21 de la gestación en ratas C y E reveló
células positivas presentes en los capilares y en
las células de la zF y de la zlR de la corteza adrenal,
mientras que en la zG no se detectaron células
inmunomarcadas. Sin embargo, otros autores han
observado células positivas para VEGF en la zG
y la zF en glándulas adrenales de bovinos13. Esto
podría deberse a diferencias que se presentan en
distintas especies de animales.
Al realizar el análisis de la
inmunolocalización en las diferentes zonas de
la corteza adrenal a lo largo de la gestación, se
evidenció una disminución del IVEGF significativa en
la zlR del grupo E con respecto al C en el día 17 de
gestación. Estudios realizados por Bozzo et al.
4
, con
el mismo modelo experimental revelaron que en las
ratas gestantes del grupo E el proceso de apoptosis
se incrementó desde la zG hasta la zlR, donde
presentó los valores más elevados. A su vez, en el
día 17 de gestación la proliferación celular en la zlR
fue significativamente menor con respecto a las zG
y la zF. Esto podría estar en relación con la teoría de
migración en la corteza adrenal, que describe las zG
y zF como un ambiente de proliferación, migración
y diferenciación celular y a la zR (específicamente
en ratas la zlR) como una región donde predomina
la muerte celular11. Asimismo, estudios previos
evidenciaron que la modulación de la angiogénesis
adrenal por la ACTH involucra a la trombospondina
2. Las células adrenocorticales de la zG y zF
producen grandes cantidades de esta proteína
en respuesta a ACTH promoviendo la adhesión y
migración celular, la angiogénesis e inhibiendo el
proceso apoptótico1
. De esta forma, su ausencia en
la zlR sería un factor que contribuye a aumentar la
apoptosis y disminuir la producción de VEGF.
Podemos concluir que los valores en los
niveles plasmáticos de CORT determinados en este
trabajo, reflejan una clara evidencia de que el estrés es
crónico y que la inmovilización representa para la rata
preñada un estímulo estresor intenso. De esta forma,
los GC maternos y/o fetales liberados en respuesta al
estrés, que atraviesa la barrera placentaria en ratas19,
afectan los procesos metabólicos y hormonales
maternos que inciden en la disminución del VEGF.
BIBLIOGRAFÍA
1. Adams, J.; Lawler, J. The thrombospondins. Cold Spring
Harb Perspect Biol. 2011; 3:a009712. DOI:10.1101/
cshperspect.a009712.
2. Bhatt, A.J.; Amin, S.B.; Chess, P.R.; Watkins, R.H.;
Maniscalco, W.M. Expression of vascular endothelial
growth factor and Flk-1 in developing and glucocorticoidtreated mouse lung. Pediatr Res. 2000; 47(5): 606–613.
3. Bin-Jaliah, I. Inducción de lesión cerebral y depresión
en ratas por estrés crónico impredecible asociado con
el aumento del estrés nitrosativo y la apoptosis. Int J
Morphol. 2020; 38(5): 1217-1222.
4. . Bozzo, A.; Soñez, C.; Monedero Cobeta, I.; Rolando, A.,
Romanini, M.; Cots, D.; Mugnaini, M. Chronic stress and
its effects on adrenal cortex apoptosis in pregnant rats.
Biotech Histochem. 2014; 89(4): 296-303.
5. Bronson, S.; Bale, T. The placenta as a mediator of
stress effects on neurodevelopmental reprogramming.
Neuropsychopharmacology. 2016; 41(1): 207-218.
6. Brunton, P.; Russell, J.; Douglas, A. Adaptive responses of
the maternal hypothalamic-pituitary-adrenal axis during
pregnancy and lactation. J Neuroendocrinol. 2008; 20(6):
764-776.
7. Buynitsky, T.; Mostofsky, D. Restraint stress in
biobehavioral research: recent developments. Neurosci
Biobehav Rev. 2009; 33(7): 1089-1098.
8. Chinn. A.; Ciais, D.; Bailly, S.; Chambaz, E.; LaMarre, J.;
Feige, J. Identification of two novel ACTH-responsive
genes encoding manganese-dependent superoxide
dismutase (SOD2) and the zinc finger protein TIS11b
[tetradecanoyl phorbol acetate (TPA)-inducible sequence
11b]. Mol Endocrinol. 2002; 16(6): 1417-1427.
9. Chrousos, G.; Gold, P. The concepts of stress and stress
system disorders: overview of physical and behavioral
homeostasis. Jama. 1992; 267(9): 1244-1252.
10. Di Rienzo, J.; Casanoves, F.; Balzarini, M.; Gonzalez, L.;
Tablada, M.; Robledo, C. InfoStat software. Córdoba,
Argentina: Universidad Nacional de Córdoba. 2016
11. Dumontet, T.; Martinez, A. Adrenal androgens, adrenarche,
and zona reticularis: A human affair? Mol Cell Endocrinol.
2021; 528:111239. DOI: 10.1016/j.mce.2021.111239
12. . Eck, J.; Kuhn, C. Effect of ether stress on growth
hormone during development in the neonatal rat.
Neuroendocrinology. 1992; 56(5): 605-610.
13. Gaillard, I.; Keramidas, M.; Liakos, P.; Vilgrain, I.; Feige,
J.; Vittet, D. ACTH‐regulated expression of vascular
endothelial growth factor in the adult bovine adrenal
cortex: A possible role in the maintenance of the
microvasculature. J Cell Physiol. 2000; 185(2): 226-234
14. Herman, J.P.; Figueiredo, H.; Mueller, N.K.; Ulrich-Lai, Y.;
Ostrander, M.M.; Choi, D.C.; Cullinan, W.E. Central mechanisms
of stress integration: hierarchical circuitry controlling
hypothalamo–pituitary–adrenocortical responsiveness.
Front Neuroendocrinol. 2003; 24(3), 151-180.
15. Herrera, E. Metabolic adaptations in pregnancy and their
implications for the availability of substrates to the fetus.
Eur J Clin Nutr. 2000: 54(1): S47-S51.
16. Levine, S. Developmental determinants of sensitivity and
resistance to stress. Psychoneuroendocrinology. 2005;
30(10): 939-946.
17. Manojlović-Stojanoski, M.; Nestorović, N.; Petković, B.;
Balind, S.R.; Ristić, N.; Trifunović, S.; et al., Milošević, V.
The effects of prenatal dexamethasone exposure and
fructose challenge on pituitary-adrenocortical activity
and anxiety-like behavior in female offspring. Tissue Cell.
2020; 62: 101309. DOI: 10.1016/j.tice.2019.101309.
18. Martinez, A.; Schedl, A. Dissecting a zonated organ–
Special issue on adrenal biology. Mol Cell Endocrinol.
2022; 539: 111486. DOI: 10.1016/j.mce.2021.111486.
19. Mayer, N.; Greco, C.; Bertuzzi, M.; Rodriguez, N.; Vivas, A.;
Gauna, H. Immobilization stress responses in adult rats
exposed in utero to immobilization. Stress Health. 2011;
27(2): e1-e10.
20. Mizoguchi, K.; Yuzurihara, M.; Ishige, A.; Sasaki, H.; Chui,
D.H.; Tabira, T. Chronic stress differentially regulates
glucocorticoid negative feedback response in rats.
Psychoneuroendocrinology. 2001; 26(5): 443-459.
21. Morohashi, K.I.; Zubair, M. The fetal and adult adrenal
cortex. Mol Cell Endocrinol. 2011; 336(1-2): 193-197.
22. Nadal, R.; Armario, A. Mecanismos de susceptibilidad al
estrés. Hipertens Riesgo Vasc. 2010; 27(3): 117-124.
23. Nauck, M.; Roth, M.; Tamm, M.; Eickelberg, O.; Wieland, H.;
Stulz, P.; Perruchoud, A.P. Induction of vascular endothelial
growth factor by platelet-activating factor and plateletderived growth factor is downregulated by corticosteroids.
Am J Respir Cell Mol Biol. 1997; 16(4): 398-406.
24. Popovska-Perčinić, F.; Manojlović-Stojanoski, M.;
Pendovski, L.; Kjovkarovska, S.D.; Miova, B.; Grubin, J.; et al.,
Ajdžanović, V. A moderate increase in ambient temperature
influences the structure and hormonal secretion of adrenal
glands in rats. Cell J. 2021; 22(4): 415-424.
25. Shibuya, M. Vascular endothelial growth factor (VEGF)
and its receptor (VEGFR) signaling in angiogenesis: a
crucial target for anti-and pro-angiogenic therapies.
Genes Cancer. 2011; 2(12): 1097-1105.
26. Sosa, E.; Liaudat, A.C.; Becerra, K.; Huck, G.; Rodriguez,
N. Effect of prenatal stress and forced swimming acute
stress on adult rat’s skeletal muscle and liver MDA levels.
MOJ Anat Physiol. 2019; 6(6): 266‒231.
27. Thomas, M.; Keramidas, M.; Monchaux, E.; Feige, J.J.
Dual hormonal regulation of endocrine tissue mass and
vasculature by adrenocorticotropin in the adrenal cortex.
Endocrinology. 2004; 145(9): 4320-4329.
28. Vásquez, B.; Sandoval, C.; Sanhueza, C.; Silva, J.; del Sol, M.
Efectos de las experiencias adversas temprana y tardía en
las características morfométricas y estereológicas de la
glándula suprarrenal de ratas sprague dawley sometidas
a estrés durante su vida adulta. Int J Morphol. 2013;
31(1): 15-22.
29. Xing, Y.; Lerario, A.M.; Rainey, W.; Hammer, G.D.
Development of adrenal cortex zonation. Endocrinol
Metab Clin North Am. 2015; 44(2): 243-274.
30. Yates, R.; Katugampola, H.; Cavlan, D.; Cogger, K.;
Meimaridou, E.; Hughes, C.; et al., King, P. Adrenocortical
development, maintenance, and disease. Curr Top Dev
Biol. 2013; 106: 239-312.





