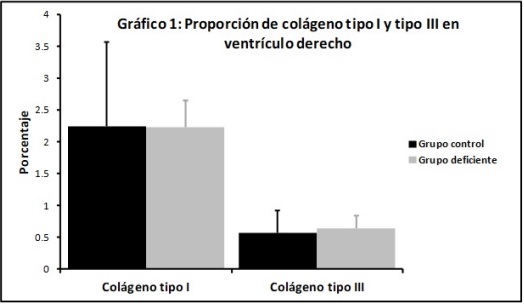
Gráfico 1:Proporción de colágeno tipo I y tipo III en ventrículo derecho.
ARTÍCULO DE INVESTIGACIÓN
Cuantificación de colágeno tipo I y tipo III en el corazón de bovinos con deficiencia secundaria de cobre
Nicastro, CN; Postma, GC; Gazzaneo, PD; Olivares, RWI; Schapira, A; Minatel, L.
Universidad de Buenos Aires, Facultad de Ciencias Veterinarias, Cátedra de Patología. Av. San Martín 5285 (1417) Ciudad Autónoma de Buenos Aires.
Recibido:15/07/2021
Aceptado:14/03/2022
Correspondencia e-mail:Carolina Nicastro cnicastro@fvet.uba.ar
Resumen
La deficiencia de cobre es una de las carencias minerales más extendidas en los bovinos de nuestro país. Una de las manifestaciones de esta deficiencia es la enfermedad de las caídas, caracterizada por lesiones en el corazón, que derivan en una insuficiencia cardíaca. El objetivo del presente trabajo fue estudiar si se producían modificaciones en la cantidad de colágeno tipo I y tipo III en el tejido conectivo del corazón de bovinos con deficiencia secundaria de cobre. Se trabajó con tacos de parafina de muestras de miocardio de 18 novillos Holando Argentino, divididos en 2 grupos (control y deficiente). Los cortes fueron coloreados con la técnica de picrosirius red y examinados bajo luz polarizada, a fin de discriminar las fibras de colágeno tipo I de las fibras de colágeno tipo III. No se observaron diferencias estadísticamente significativas entre los dos grupos para el porcentaje de colágeno tipo I (p = 0,7409) y tipo III (p = 0,5227), ni para la relación entre ambos colágenos (p = 0,9623). Es probable que el tiempo de deficiencia transcurrido en este caso no haya sido suficiente para inducir alteraciones en las cantidades de fibras colágenas I y III en los animales del grupo deficiente.
Palabras clave:bovinos, deficiencia de cobre, corazón, tejido conectivo
Collagen type I and III quantification in hearts from bovines with secondary copper deficiency
Summary
Copper deficiency is an important disease of cattle in our country. One manifestation of copper deficiency is falling disease, characterized by heart lesions that lead to heart failure. The aim of this work was to study if there were any changes in the amount of collagen type I and type III in the connective tissue of the heart in cattle with secondary copper deficiency. Paraffin blocks from 18 myocardial samples of 18 Holando Argentino calves, divided into 2 groups (control group and deficient group), were used. Sections were colored with the picrosirius red technique, and examined under polarized light, in order to discriminated type I collagen fibers from type III collagen fibers. No statistically significant differences were found between the two groups for the percentage of collagen type I (p = 0.7409) and type III (p = 0.5227), nor for the relation between both collagens (p = 0.9623). It is probable that the deficiency was not extended enough to induce alterations in the amount of type I and type III collagen fibers of the Cu-deficient bovines.
Key words:bovine, copper deficiency, heart, connective tissue
INTRODUCCIÓN
La deficiencia de cobre (Cu), conocida
como hipocuprosis, es una de las carencias
minerales más frecuentes en el mundo14 y una de
las más extendidas en nuestro país12, que afecta
principalmente a bovinos en sistemas de tipo
extensivos. Puede afectar a distintas categorías,
produciendo signología clínica variable, ya que
interviene en numerosos procesos biológicos
como cofactor de varias enzimas denominadas
cupro-enzimas. Los primeros reportes datan
del año 1929, donde en Australia Occidental se
dio a conocer una enfermedad bajo el nombre
de “mal de las caídas”, llamada así ya que el
ganado afectado moría en forma súbita debido
a una falla cardíaca aguda, como consecuencia
de una fibrosis miocárdica1. Años más tarde se
identificó en ensayos experimentales en ratones
que la deficiencia de Cu generaba alteraciones
en los colágenos tipo I, III y IV de las membranas
basales (MBs) cardíacas5. Es importante
destacar que la mayoría de las investigaciones
sobre la relación entre deficiencia de Cu y
lesiones cardíacas se realizaron principalmente
en animales de laboratorio. Esto impulsó
a nuestro grupo de trabajo, que había
desarrollado un modelo experimental de
inducción de deficiencia de Cu en bovinos10, a
llevar adelante investigaciones sobre los efectos
de la deficiencia a nivel cardíaco. En estas
investigaciones se observó que en el corazón de
los bovinos con deficiencia de Cu disminuyó la
actividad de las enzimas superóxido dismutasa
(SOD), ciclo oxigenasa (COX)11 y lisil oxidasa
(LOX)13, y se produjo un aumento del estrés
oxidativo. Entre las alteraciones morfológicas
del miocardio se identificaron alteraciones
mitocondriales con microscopía electrónica,
como tumefacción, formación de crestas y
fusión de las mitocondrias, y un aumento en la
cantidad de tejido conectivo y en el espesor de
las MBs11, con microscopía óptica.
La técnica histoquímica de picrosirius
red es un método específico para la identificación
de fibras colágenas, que adoptan una tinción de
color rojo. Con el empleo de luz polarizada es
posible discriminar entre las fibras de colágeno
tipo I y tipo III, bajo el fundamento de la
birrefringencia y de la anisotropía de las fibras
colágenas7. Cuando la luz golpea a un material
anisotrópico, se refracta en dos rayos que viajan
a diferentes velocidades y con direcciones
de vibración orientadas a 90° entre sí. El
picrosorius red es una molécula birrefringente
alargada y cuando se une al colágeno se orienta
en paralelo a las fibras; esto ayuda a amplificar
la birrefringencia14. Gowda y col.6 sostienen que
las fibras de colágeno tipo I son fibras gruesas,
fuertemente birrefringentes, y eso hace que se
vean de color amarillas o rojas, mientras que
las fibras de colágeno tipo III son delgadas,
débilmente birrefringentes y por eso se ven de
color verde.
El objetivo del presente trabajo fue
estudiar si se produjeron modificaciones en la
cantidad de colágeno tipo I y tipo III en el tejido
conectivo del corazón de bovinos con deficiencia
secundaria de Cu.
MATERIALES Y MÉTODOS
Se emplearon muestras de miocardio
del ventrículo derecho (VD) provenientes
de 18 terneros machos, Holando Argentino,
pertenecientes a dos ensayos consecutivos
similares realizados en la Cátedra de Patología
de la Facultad de Ciencias Veterinarias,
Universidad de Buenos Aires. Ambos ensayos
habían sido aprobados oportunamente por
el comité de ética de la Facultad (CICUAL). En
cada ensayo los animales fueron divididos en
dos grupos (control y deficiente). La confección
de los grupos, la dieta recibida y los valores
de Cu en plasma e hígado de cada grupo al
comienzo y al final de cada ensayo fueron
descriptos oportunamente11. Resumidamente,
se dividieron a los animales en dos grupos
(control y deficiente) según el peso y los niveles
hepáticos de Cu. Los animales del grupo control
(n = 9) recibieron una dieta base suplementada
con 9 mg Cu/kg materia seca (MS) como sulfato
de Cu; mientras que el grupo deficiente (n = 9)
recibió la dieta base suplementada con 11 mg
molibdeno/kg MS como molibdato de sodio,
para alcanzar una relación Cu/Mo de 1:3, y 3 g
azufre/kg de MS como sulfato de sodio. La dieta
base contenía 3,8 mg Cu/kg MS; 0,4 g Mo/kg MS
y 0,4 g S/kg MS. Los animales tenían acceso libre
al agua de bebida. Los valores de Cu hepático al
inicio de los ensayos fueron de 851,8 ± 165,9
µg/g MS para el grupo control y de 829, 4 ± 201,3
µg/g MS para el grupo deficiente; mientras que
los valores de Cu plasmático fueron de 89,5 ± 8,1
µg/dl para el grupo control y de 84,7 ± 9,7 µg/dl
para el grupo deficiente. Al finalizar los ensayos,
los valores de Cu hepático fueron de 182,6 ±
71,1 µg/g MS para el grupo control y de 6,3 ±
1,1 µg/g MS para el grupo deficiente; mientras
que los valores de Cu plasmático fueron de 67,9
± 13 µg/dl para el grupo control y de 23,7 ± 6,2
µg/dl para el grupo deficiente.
Para la identificación de fibras colágenas
de tipo I y de tipo III se realizó la técnica de
picrosirius red (Direct Red 80, Biotechnologies,Santa Cruz, USA) bajo luz polarizada7
. Se utilizaron
tacos de parafina de los cuales se obtuvieron
cortes de 5 µ de espesor. Los cortes fueron
desparafinados e hidratados. Luego se colocaron
en hematoxilina de Weigert (Hematoxilina
Férrica de Weigert, Biopack, Buenos Aires,
Argentina) por 10 minutos. A continuación,
fueron sumergidos en la Solución A (Sirius red
en solución sobresaturada de ácido pícrico) por
una hora y luego lavados con la Solución B (ácido
acético al 0,5 % en solución acuosa). Finalmente,
se deshidrataron, se aclararon con 2 pasajes en
xilol (10 minutos cada uno) y se montaron con
medios sintéticos.
A partir de los cortes teñidos y bajo la
luz polarizada, se evaluaron a ciego 6 imágenes
a 100X por cada animal. Luego se procedió
a cuantificar el tejido conectivo mediante el
software Fiji Image J, para lo cual se cambió la
imagen a tipo HSB, para luego descomponerla en
3 canales (brillo, saturación y matiz). Se trabajó
sobre el canal de brillo, en el cual se seleccionó
un área de interés a través de distintos filtros
para hacerla más específica. Dicho trabajo se
realizó por separado para cada colágeno. Con
cada selección se calculó el área que ocupaba
cada uno de los colágenos con respecto al área
total evaluada en cada imagen de cada animal,
obteniéndose un valor promedio por animal.
Los datos obtenidos de los porcentajes
de cada tipo de colágeno con la técnica de
picrosirius red fueron comparados entre ambos
grupos utilizando un test t de Student, previa
verificación del supuesto de normalidad de las
variables en estudio con la prueba de Shapiro
Wilk. El nivel de significación establecido para
ambos test fue del 95 %. Para estos análisis se
empleó el programa Statistix 8.0.
RESULTADOS
En el grupo control la proporción de
colágeno tipo I con respecto al área total fue de
2,19 ± 1,24 %, mientras que el grupo deficiente
mostró valores de 2,04 ± 0,67 % (Gráfico 1).
Para el colágeno tipo III, el grupo control exhibió
valores de 0,52 ± 0,35 % y el grupo deficiente
de 0,61 ± 0,21 % (Gráfico 1). En cuanto a la
relación entre el colágeno tipo III/I en el grupo
control fue de 0,24 y en el grupo deficiente fue
de 0,30 (Gráfico 2). No se observaron diferenciasestadísticamente significativas entre los dos
grupos (control y deficiente) para el porcentaje
de colágeno tipo I (p = 0,7409) y tipo III (p
= 0,5227), ni para la relación entre ambos
colágenos (p = 0,9623).
Las imágenes 1 y 2 corresponden a la
tinción de picrosirius red de animales del grupo
control y deficiente, respectivamente, sin luz
polarizada, con luz polarizada y con el análisis
del programa Fiji Image J.

Gráfico 1:Proporción de colágeno tipo I y tipo III en ventrículo derecho.
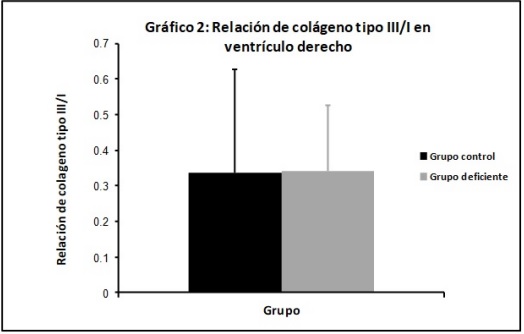
Gráfico 2: Relación de colágeno tipo III/I en ventrículo derecho.
Cuantificación de colágeno con picrosirius red en corazones de bovinos con deficiencia de cobre
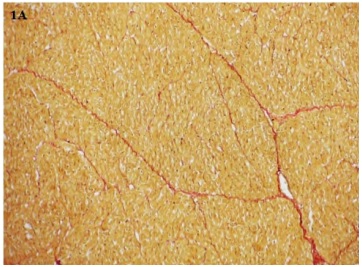
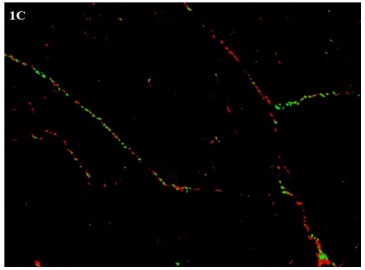
Imagen 1. Imagen de un corte de ventrículo derecho del animal 41 del grupo control teñido con picrosirius red
(100X).A.Microscopía óptica común.. B.Con luz polarizada. Nótese las coloraciones roja y amarilla (colágeno tipo I)
y verde (colágeno tipo III). C. Imagen obtenida por el software Fiji Image J.
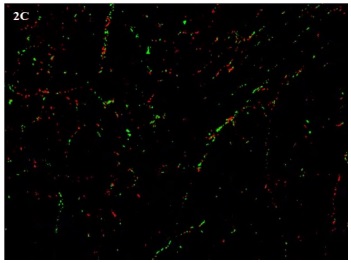
Imagen 2. Imagen de un corte de ventrículo derecho del animal 35 del grupo deficiente teñido con picrosirius red
(100X).A.Microscopía óptica común.. B. Con luz polarizada. Nótese las coloraciones roja y amarilla (colágeno tipo I)
y verde (colágeno tipo III). C.Imagen obtenida por el software Fiji Image J.
DISCUSIÓN
El grupo de investigación de la Cátedra de
Patología de la Facultad de Ciencias Veterinarias
de la Universidad de Buenos Aires reportó, en
investigaciones anteriores, un mayor depósito
de tejido conectivo y alteraciones en las MBs
del miocardio de bovinos con deficiencia de
Cu, atribuible al estrés oxidativo que sufrieron
las células a causa de una disminución de la
actividad de las enzimas COX, SOD11 y LOX13.
Estos hallazgos plantearon nuevos interrogantes,
que abrieron el camino a futuras investigaciones.
En este trabajo se empleó la técnica
histoquímica de picrosirius red bajo luz
polarizada, con el objetivo de estudiar si existían
diferencias en la cantidad de fibras colágenas
de tipo I y tipo III en el corazón de bovinos con
deficiencia secundaria de Cu, considerando que
frente a un proceso de reparación del tejido se
produce un aumento de ambos colágenos.
La muerte de las células miocárdicas
suele ser el evento inicial para el desarrollo
de la respuesta de reparación por fibrosis
debido a la activación de señales fibrogénicas
en el miocardio 8, siendo reemplazadas
p r i n c i p a l m e n t e , c o m o m e n c i o n a m o s
anteriormente, por fibras de colágeno tipo I y
tipo III para preservar la integridad estructural
del tejido17. El proceso de reparación de un
tejido consta de una fase temprana y una
fase tardía. Durante la fase temprana hay un
aumento de la síntesis de colágeno tipo III3,9,
siendo mayor la proporción de este tipo de
colágeno con respecto al tipo I, mientras que
en la fase tardía esa proporción se invierte. En
ensayos experimentales en corazones de ratas
con deficiencia de Cu se obtuvo una mayor
proporción de colágeno tipo III y una mayor
cantidad de la fracción extraíble con pepsina
de dicho colágeno (esta fracción es soluble
y pertenece al colágeno recién sintetizado);
sin embargo, no se obtuvieron diferencias
significativas en el colágeno total entre ambos
grupos 4,18. Otros ensayos experimentales
similares en ratas deficientes de Cu realizaron la
técnica de inmunohistoquímica2 para colágeno
tipo I y tipo III en músculo esquelético y cardíaco,
en los cuales observaron ligeras diferencias en
la marcación de las muestras provenientes de
animales deficientes de Cu, pero las mismas
no fueron estadísticamente significativas.
Vadlamudi y col.16 trabajaron con miocardio de
cerdos deficientes de Cu, en donde encontraron
que la proporción de colágeno tipo III era entre
un 25 a 40 % más alta en el grupo deficiente con
respecto al grupo control.
Para poder entender los hallazgos
de las diferentes investigaciones es
primordial conocer las diferentes fases
que transcurren durante una deficiencia
mineral. Según Suttle15 una deficiencia
mineral consta de 4 fases, donde cada una
de ellas se caracteriza por sufrir distintos
cambios bioquímicos que conducen a la
aparición de los signos clínicos. Las fases
son depleción, deficiencia, disfunción
enzimática y, por último, enfermedad. La
primera fase de depleción de la deficiencia
de Cu se produce cuando el aporte mineral
en la dieta no cubre los requerimientos de
Cu del organismo, lo que obliga al animal
a utilizar el Cu almacenado en el hígado
para poder cubrirlos. La única manifestación
durante esta etapa es la disminución de los
valores de Cu hepáticos. Durante la segunda
fase de deficiencia las reservas hepáticas
disminuyen drásticamente y no pueden
mantener los niveles de Cu normales en
sangre (mayores a 60 µg/dl), por lo que
esta etapa se caracteriza por bajos valores
de Cu en plasma o suero. Durante la fase
de disfunción enzimática, la reducción del
aporte de Cu a los tejidos, consecuencia
de los bajo niveles plasmáticos, conduce a
una disminución de la funcionalidad de las
enzimas Cu-dependientes, lo cual culmina
con la aparición de signos clínicos propios de
la enfermedad (cuarta fase). Es importante
remarcar que los signos clínicos no aparecen
todos al mismo tiempo, sino que se dan de
forma gradual, debido a que la disminución de
la actividad de las enzimas Cu-dependientes
sucede a distintas velocidades, dependiendo
de la vida media de la enzima afectada. Por
ejemplo, la acromotriquia, que es la pérdida
de color del pelo por fallas en la actividad
de la enzima tirosinasa, es el signo clínico
más precoz de la hipocuprosis y, durante el
desarrollo de nuestros ensayos, se manifestó
en los bovinos del grupo deficiente alrededor
de los ojos.
Si bien en el presente trabajo se observó
un ligero incremento de colágeno tipo III en
el grupo deficiente, la ausencia de diferencias
estadísticamente significativas entre ambos
grupos posiblemente se haya debido a un período
de deficiencia insuficiente. Es un hecho que los
bovinos pertenecientes al grupo deficiente de Cu
se encontraban cursando la fase de disfunción
enzimática, dada la disminución de la actividad
de las enzimas COX, SOD11 y LOX13 en el miocardio,
y la aparición de acromotriquia periocular en
varios animales. Sin embargo, es probable que
esta disfunción de las enzimas miocárdicas aún
no hubiera tenido consecuencias graves para
las células miocárdicas y, por lo tanto, no se
hubiese desencadenado todavía un proceso de
reparación evidente.
CONCLUSIÓN
La ausencia de diferencias estadísticamente significativas en la proporción de colágenos tipo I y tipo III, y en la relación entre ambos en el miocardio de bovinos con y sin deficiencia de Cu, podría deberse a un período de deficiencia insuficiente. Se deberían realizar nuevos estudios experimentales, con un tiempo de deficiencia superior, o estudios a campo utilizando muestras de corazón obtenidas en frigoríficos, pertenecientes a bovinos adultos que provengan de zonas del país con deficiencia de Cu, que permitan corroborar esta hipótesis.
AGRADECIMIENTOS
Este trabajo fue realizado en el marco del subsidio UBACyT N°20020150100113BA.
1. Bennetts, HW.; Beck, AB.; Harley, R. The pathogenesis of
Falling Disease. Studies on copper deficiency in cattle.
Aust. Vet. J. 1948; 9:237-244.
2. Borg, TK.; Klevay, LM.; Gay, RE.; Siegel, R.; Bergin, ME.
(1985). Alteration of the connective tissue network
of striated muscle in copper deficient rats. J. Mol. Cell.
Cardiol. 1985; 17(12):1173–1183.
3. Carver, W.; Nagpal, ML.; Nachtigal, M.; Borg, TK.; Terracio,
L. Collagen expression in mechanically stimulated cardiac
fibroblasts. Circ. Res. 1991; 69(1):116–122.
4. Dawson, R.; Milne, G.; Williams, RB. Changes in the
collagen of rat heart in copper-deficiency-induced cardiac
hypertrophy. Cardiovasc. Res. 1982;16(10):559–565.
5. Farquharson, C.; Robins, SP. Immunolocalization of
collagen types I, III and IV, elastin and fibronectin within
the heart of normal and copper-deficient rats. J. Comp.
Pathol. 1991; 104(3):245–255.
6. Gowda, BK.; Kokila, J.; Gopinathan, PA.; Praveen, KS.
Picrosirius Red and Polarization Microscopy – A Tool
for Gender Differentiation. J. Clin. Diagn. Res. 2017;
11(1):107-109.
7. Junqueira, LC.; Cossermelli, W.; Brentani, R. Differential staining
of collagens type I, II and III by Sirius Red and polarization
microscopy. Arch. Histol. Japon. 1978; 41(3):267–274.
8. Kong, P.; Christia, P.; Frangogiannis, NG. The pathogenesis
of cardiac fibrosis. Cell. Mol. Life Sci. 2013; 71(4):549-574.
9. Li, L.; Zhao, Q.; Kong, W. Extracellular matrix remodeling
and cardiac fibrosis. Matrix Biol. 2018; 68-69:490-506.
10. Minatel L.; Underwood SC.; Postma GC.; Dallorso ME.;
Carfagnini JC. Reproducción de la deficiencia de cobre en
bovinos mediante el empleo de altos niveles de molibdeno y
sulfato en la dieta. Rev. Arg. Prod. Anim. 2007; 27(3): 179-187.
11. Olivares, RWI.; Postma, GC.; Schapira A.; et al.
Biochemical and morphological alterations in hearts of
copper-deficient bovines. Biol. Trace Elem. Res. 2019;
189(2):447–455.
12. Postma, GC.; Minatel, L.; Carfagnini, JC. Deficiencia de
cobre en bovinos en pastoreo de la argentina. Rev. Arg.
Prod. Anim. 2010; 30(2):189-198.
13. Postma, GC.; Nicastro, CN.; Valdez LB.; et al. Decrease lysyl
oxidase activity in hearts of copper-deficient bovines. J.
Trace Elem. Med. Biol. 2021; 65:126715. doi: 10.1016/j.
jtemb.2021.126715
14. Rittié, L. Method for Picrosirius Red-Polarization
Detection of Collagen Fibers in Tissue Sections. Methods
in Molecular Biology, Springer, USA, 2017:395-407.
15. Suttle NF. Mineral nutrition of livestock. 4° ed., CABI
Publishing, U.K., 2010:255-305.
16. Vadlamudi, RK.; McCormick, RJ.; Medeiros, DM.;
Vossoughi, J.; Failla, ML. Copper deficiency alters collagen
types and covalent cross-linking in swine myocardium
and cardiac valves. Am. J. Physiol. 1993; 264(6):2154–
2161.
17. Weber, KT.; Sun, Y.; Bhattacharya, SK.; Ahokas, RA.;
Gerling, IC. Myofibroblast mediated mechanisms of
pathological remodelling of the heart. Nat. Rev. Cardiol.
2013;10(1):15-26.
18. Werman, MJ.; David, R. Lysyl oxidasa activity, collagen
cross-links and connective tissue ultraestructure in the
heart of copper-deficient male rats. J. Nutr. Biochem.
1996; 7(8):437-444.