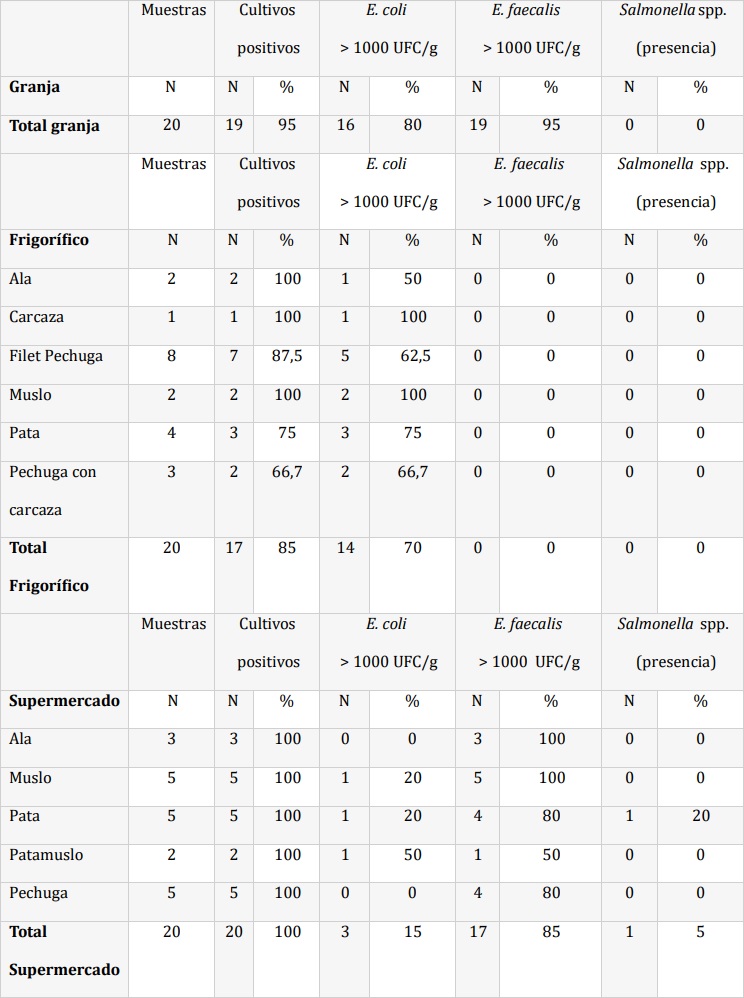
Tabla 1:: Aislamientos según procedencia (N= número de muestras)
ARTÍCULO DE INVESTIGACIÓN
Resistencia a antimicrobianos en bacterias aisladas en la cadena de producción avícola
López, V 1 ; Guerriero, L 2 ; Elorza, V 2 ; Krüger, A 1,3 ; Colello, R 1,3 ; Medici, S 4 ; Espinosa, M 4 ;Casado, P 4 ; Recavarren, M 1.2 ; Keller, L 2
1
Facultad de Ciencias Veterinarias, UNCPBA, Tandil.
2
Fares Taie Instituto de Análisis Mar del Plata.
3Centro de Investigación
Veterinaria de Tandil (CIVETAN) (CONICET-CICPBA-UNCPBA). Tandil.
4
Centro de Alimentos y Medio Ambiente Fares
Taie Instituto de Análisis. Mar del Plata.
Recibido: 03/09/2021
Aceptado: 17/12/2021
Correspondencia e-mail: Lorena Keller lkeller@farestaie.com.ar
Resumen
La resistencia bacteriana a los antimicrobianos es un problema global. Una posible causa de aparición de resistencia es su uso como promotores de crecimiento en aves. Esto puede producir fallos terapéuticos e incrementar la transmisión de bacterias resistentes al hombre. El objetivo de este trabajo fue determinar la sensibilidad a antimicrobianos en bacterias aisladas de aves y subproductos para consumo humano. Se estudiaron 60 muestras, aislándose Escherichia coli, Salmonella spp. y Enterococcus faecalis. Un 80 % de las muestras de granja presentaron recuentos >103 UFC/g para E. coli y 95 % para E. faecalis; 70 % de las de frigorífico tuvieron recuentos >103 UFC/g de E. coli y 85 % de las de supermercado presentaron recuentos >103 UFC/g de E. faecalis, 15% de E. coli; y 5 % presentó desarrollo de Salmonella spp. De 53 aislamientos de E. coli, 47,1% fueron resistentes a fluoroquinolonas, 9,4 % resistentes a cefalosporinas de tercera generación, y 3,8 % a colistina. De 39 cepas de E. faecalis, una fue resistente a ciprofloxacina, y ninguna a vancomicina. El aislamiento de Salmonella spp. fue resistente a ciprofloxacina. Nuestros resultados revelarían la necesidad de intensificar los controles higiénico-sanitarios en la cadena de manipulación de aves, e implementar mejoras para la reducción de patógenos.
Palabras clave: subproductos avícolas, bacterias, resistencia antimicrobiana
Resistance to antimicrobials in poultry production chain isolated bacteria
Summary
Bacterial resistance to antimicrobials is a global problem. A possible cause of the emergence of resistance is their use as growth promoters. This can cause therapeutic failures and increase the transmission of resistant bacteria. The objective of this work was to determine the sensitivity to antimicrobials of isolated bacteria from poultry and products for human consumption. Sixty samples were studied and Escherichia coli, Salmonella spp. and Enterococcus faecalis were isolated. Around 80 % of the farm samples showed counts of >103 UFC/g for E. coli and 95 % for E. faecalis; 70 % of the refrigerated samples showed counts of >103 UFC/g for E. coli, and 85 % of the market samples showed counts of > 103 CFU /g for E. faecalis, 15 % for E. coli; and 5 % developed Salmonella spp. Of the 53 E. coli isolations, 47.1 % were resistant to fluoroquinolones, 9.4 % to third-generation cephalosporins, and 3.8 % to colistin. Of the 39 E. faecalis isolated strains, one was resistant to ciprofloxacin, and none to vancomycin. The isolated Salmonella spp. was resistant to ciprofloxacin. Our results reveal the need to intensify sanitary and hygiene controls poultry manipulation chain and implement improvements to pathogens reduction.
Key words: poultry products, bacteria, antimicrobial resistance
INTRODUCCIÓN
El uso inadecuado de agentes antimicrobianos en seres humanos y en animales de producción
tiene consecuencias importantes para la salud humana y animal1
. El riesgo más grande para la salud
de los consumidores de productos de origen animal
no está dado solamente por los residuos farmacológicos, sino también por el desarrollo de bacterias
resistentes a antimicrobianos. Hasta la fecha, se han
descrito microorganismos resistentes a antimicrobianos en humanos, animales, alimentos y el medio
ambiente; por este motivo es importante el compromiso de todos los sectores, instando a que no se
prescriban antibióticos sin necesidad, evitando la
automedicación y el empleo innecesario de antibióticos en la producción agroalimentaria. De esta forma se podría evitar que se aceleren los procesos que
incrementan la resistencia antimicrobiana (RAM)9
.
Se considera que bacterias como E. coli y
Salmonella spp. multirresistentes y Enterococcus
vancomicina resistentes habrían emergido, en
parte, por el uso agropecuario de antimicrobianos.
Esto ha generado una permanente discusión sobre
la transmisión de bacterias resistentes de los animales al hombre y sobre la utilización de antibióticos a dosis subterapéuticas para la prevención de
enfermedades o para el aprovechamiento de sus
beneficios en el proceso productivo10. Actualmente se considera que su utilización para estas aplicaciones proporciona condiciones favorables para
la emergencia, el desarrollo, la propagación y la
persistencia de bacterias resistentes que pueden
causar infecciones en animales y humanos3
.
En nuestro país, se creó en el año 2015 el
Programa Nacional de Vigilancia de RAM en animales de consumo humano, atendiendo a lo dispuesto en la Resolución Conjunta 834 del Ministerio de Salud y 391 del Ministerio de Agricultura,
Ganadería y Pesca, en la cual se establece la Estrategia Argentina para el Control de la RAM4
.
La contaminación de la carne de aves de
corral con bacterias, principalmente de origen
fecal, a través del procesamiento, manejo, comercialización y almacenamiento, puede conducir a
enfermedades en humanos. Entre los principales
agentes bacterianos causantes de infecciones intestinales humanas asociadas a productos avícolas se encuentran Salmonella spp. y E. coli 2, 27. Las
infecciones causadas por bacterias resistentes a
antimicrobianos presentan un desafío para su
tratamiento. A su vez, se produce un incremento
en los costos médicos, se prolongan las estancias
hospitalarias y aumenta la mortalidad29. Uno de
los mecanismos más importantes en las bacterias
gram negativas es la producción de betalactamasas, enzimas capaces de inactivar a los antibióticos
betalactámicos. Dentro de este grupo, las betalactamasas de espectro extendido (BLEE) confieren
resistencia a penicilinas, oximino-cefalosporinas
(cefotaxima, ceftriaxona, ceftazidima, cefepima) y
monobactámicos (aztreonam). Pueden ser inhibidas por ácido clavulánico u otros inhibidores de
β-lactamasas como tazobactam y sulbactam20, 23.
Por su asociación a enfermedades transmitidas por alimentos, la relevancia de la resistencia y su uso como indicador de contaminación
fecal, el objetivo de este trabajo fue caracterizar la
RAM en aislamientos de E. coli, Salmonella spp. y
Enterococcus spp., obtenidos a partir de muestras
de origen avícola para consumo humano, en las diferentes etapas del proceso de producción (granja, frigorífico y supermercado).
MATERIALES Y MÉTODOS
Se recolectaron 60 muestras en 3 etapas de la cadena productiva de una misma empresa (granja, frigorífico y supermercado) de la provincia de Buenos Aires en el año 2018: 20 muestras en granja (pollos), 20 muestras en frigorífico (filet de pechuga, muslo, pata, pechuga con carcasa, carcasa y ala) y 20 muestras en supermercado (ala, pechuga, muslo, pata y patamuslo). Las mismas se recolectaron con guantes y bolsas de cortes y se transportaron rotuladas y refrigeradas hasta el laboratorio para su procesamiento. Los análisis microbiológicos se realizaron en el Centro de Alimentos y Medio Ambiente, Instituto de Análisis Fares Taie de la ciudad de Mar del Plata.
Detección de E. coli
Se siguió la metodología de acuerdo con la norma ISO 16649-1:201816. Se contaron las unidades formadoras de colonias (UFC) de E. coli, que fueron identificadas mediante pruebas bioquímicas: TSI (triple azúcar hierro), citrato de Simmons, SIM (SH2 , indol y movilidad), urea de Christensen, LIA (lisina hierro), y MIO (movilidad, indol, ornitina).
Detección de Salmonella spp.
Se siguió la norma ISO 6579-1:201715. Las colonias presuntivas se confirmaron mediante pruebas bioquímicas TSI, citrato de Simmons, SIM, urea, LIA, y MIO.
Detección de Enterococcus spp.
Se realizó según la norma ISO 7899- 2:200014. Las colonias fueron identificadas mediante pruebas bioquímicas (l-pirrolidonilarilamidasa-Pyr, crecimiento en cloruro de sodio, bilis esculina y telurito).
Conservación de los aislamientos
En los casos que hubo crecimiento, se tomaron colonias individuales de la máxima dilución positiva y se colocaron en crioviales conteniendo caldo nutritivo con 10 % de glicerol. Los aislamientos se conservaron a -70 ºC.
Interpretación de resultados
E. coli: teniendo en cuenta los criterios
microbiológicos nacionales e internacionales recomendados en aves26,28, se estableció como criterio
inaceptable cualquier recuento > 1.000 UFC/g.
Salmonella spp.: se consideró inaceptable
su presencia en 25 g de muestra, siguiendo el criterio
obligatorio de la Resolución N° 198/95 de SENASA26.
Enterococcus spp.: considerando que no
existen criterios microbiológicos para pollos y que
se trata de un microorganismo fecal, se utilizó el mismo punto de corte que para E. coli.
Evaluación de resistencia a antimicrobianos
Los estudios de susceptibilidad a los antimicrobianos se realizaron utilizando la técnica de
difusión con discos en medio sólido según normas
estandarizadas del CLSI-M1008
. Los antibióticos
ensayados fueron:
- Cefalotina (CTN) 30 µg, ciprofloxacina (CIP) 5 µg,
ac. nalidíxico (NAL) 30 µg, imipenem (IMI) 10 µg y
colistina (COL) 10 µg, para E. coli y Salmonella spp.
- Vancomicina (VAN) 30 µg, para Enterococcus spp.
Se incubó en estufa de 37 ºC por 24 h y se
midieron los halos de inhibición interpretándose
como sensible (S), intermedio (I) o resistente (R) según las categorías establecidas en la norma vigente.
En las cepas que presentaron resistencia a CTN (halo
≤ 14 mm) se realizó una prueba fenotípica para detección de BLEE con discos de ceftazidima (30 µg),
amoxicilina + ácido clavulánico (AMC) 30 µg y cefotaxima (30 µg), para evaluar el efecto sinérgico entre
AMC y las cefalosporinas de tercera generación.
RESULTADOS
Se analizaron 60 muestras de pollos obtenidas de granja, frigorífico y supermercado. En la Tabla 1 se indica procedencia de cada muestra, cantidad y porcentaje de aislamientos obtenidos. La única especie de enterococos hallada fue Enterococcus faecalis. A partir del análisis de los resultados, se observó que un 80 % de las muestras obtenidas en granja presentaron recuentos inaceptables (es decir > 1.000 UFC/g) para E. coli y un 95 % para E. faecalis. De las muestras obtenidas en frigorífico, 17 (85 %) tuvieron crecimiento de E. coli, siendo inaceptables 14 (70 %). En ninguna se aislaron enterococos ni Salmonella spp. Tomando en cuenta las distintas partes del pollo, en carcasa y muslo el 100 % de los cultivos fueron positivos a E. coli. Mientras que en ala, filet pechuga, pata y pechuga con carcasa, el porcentaje con recuentos inaceptables fue del 50 %, 62,5 %, 75 % y 66,7 %, respectivamente. De las muestras de supermercado, el 100 % de los cultivos fueron positivos al menos a uno de los microorganismos buscados. El 85 % de las muestras presentaron recuentos inaceptables de E. faecalis y el 15 % de E. coli. Tomando en cuenta las distintas partes del pollo, E. coli se aisló con mayor frecuencia en patamuslo (50 %), seguido de pata y muslo (20 %). El 5 %, correspondiente a una muestra de pata, presentó recuentos inaceptables para Salmonella spp., E. coli y E. faecalis. Los aislamientos obtenidos fueron analizados frente a distintos antimicrobianos. En este análisis se incluyeron el total de aislamientos obtenidos independientemente del recuento, para tener valores representativos de la RAM. Del total de muestras analizadas se obtuvieron 93 aislamientos, 53 de E. coli, 39 de E. faecalis y 1 de Salmonella spp. En la Tabla 2 se muestran los mecanismos de resistencia presentes en E. coli, donde se observa que el más frecuente fue la sensibilidad disminuida a CIP, presente en 47,1 % de los aislamientos, con resistencia acompañante a cefalosporinas de tercera generación por mecanismo BLEE en 9,4 % de los mismos. La resistencia a COL fue de 3,8 %. En E. faecalis solamente un aislamiento (2,6 %) presentó resistencia a CIP, al igual que la única cepa de Salmonella spp. Ninguna cepa de E. coli presentó resistencia a carbapenemes y no observamos resistencia a VAN en E. faecalis.
Tabla 1:: Aislamientos según procedencia (N= número de muestras)

Tabla 2:: Perfil de resistencia a los antimicrobianos en E. coli
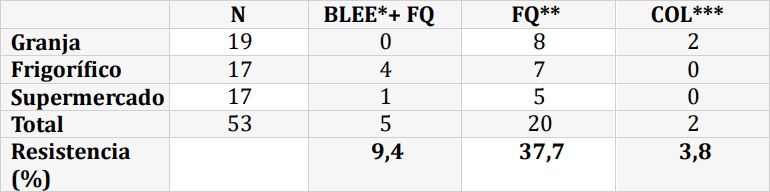
N: número de aislamientos analizados
* BLEE indica detección de Betalactamasas de espectro extendido
**FQ: fluoroquinolonas; ***COL: colistina
DISCUSIÓN
El sector avícola continúa creciendo e industrializándose en muchas partes del mundo11.
Sin embargo, algunas prácticas de la producción
de carne de aves a gran escala han generado problemas sanitarios, entre ellos la transmisión de
bacterias patógenas al hombre y la selección de
bacterias resistentes a antimicrobianos5
. Este trabajo tuvo como objetivo caracterizar la RAM de los
aislamientos de E. coli, Salmonella spp. y Enterococcus spp., obtenidos en las distintas etapas de la
cadena productiva de carne avícola.
En el análisis de las muestras de granja, se
aislaron cepas de E. coli y E. faecalis en altos porcentajes (80 % y 95 %, respectivamente). Por otro
lado, y a pesar de que estudios en granjas de las
provincias de Buenos Aires y Entre Ríos, en el marco de la vigilancia epidemiológica del SENASA,
estiman una prevalencia de 43-45 %12, en nuestro estudio no detectamos Salmonella spp., en esta etapa.
Un alto porcentaje de muestras obtenidas
en frigorífico (70 %) resultaron inaceptables por
altos recuentos de E. coli. Se ha sugerido que la
contaminación cruzada entre aves vivas y canales,
y temperaturas incorrectas en los distintos procesos, entre otros factores, contribuirían a la propagación bacteriana en mataderos5
, coincidiendo
con nuestra apreciación, si bien estos factores no
fueron examinados en nuestro trabajo.
También en las muestras de supermercado se observó alta contaminación fecal a través
de la detección de un alto porcentaje (85 %) de
muestras con altos recuentos de E. faecalis, con un
porcentaje bastante menor (15 %) de recuentos
inaceptables de E. coli. Fallas en la cadena de manipulación debido a malas prácticas higiénicas de
los operarios, en el traslado debido a la contaminación de los elementos y variaciones de temperatura, y también en la comercialización, podrían
ser algunos de los factores que contribuyen a la
contaminación observada en los productos de supermercado13. En nuestro estudio, el porcentaje
de E. coli en muestras de supermercado fue mucho
menor que en las muestras de granja y frigorífico,
lo que demuestra que los lavados y procesos a los
que son sometidas las aves antes de comercializarse habrían sido eficientes. Sin embargo, debemos
aclarar que el punto de corte de inaceptable para
Enterococcus spp., al no hallarse establecido en
ninguna norma nacional ni internacional, se consideró igual al de E. coli, de manera que podríamos
estar sobreestimando el porcentaje de muestras
inaceptables por contaminación con enterococos
en muestras de supermercado.
Se detectó Salmonella spp. en una muestra
de pata, la cual representó el 5 % de las muestras
de supermercado analizadas. Si bien esta cifra es
menor a la reportada en un trabajo en El Salvador
(Centro América), en el que se identificó Salmonella
spp. en un 56 % de las muestras de carne de pollo
fresco colectadas en supermercados18, la presencia
de Salmonella spp. es indicadora de contaminación
fecal e implica un alto riesgo de consumo debido a
que puede causar intoxicación alimentaria19.
El desarrollo y utilización de antimicrobianos ha sido de gran importancia para la resolución de muchas infecciones.
La presión de selección que estos antimicrobianos ejercen sobre las
bacterias favorece la aparición y diseminación de
distintos mecanismos de resistencia a nivel mundial. El fenómeno de la RAM se ve impulsado por
el uso de estas drogas en medicina veterinaria y
humana, y también en la producción de alimentos24.
Diversos estudios demuestran que la situación de RAM es alarmante en todo el mundo. En
China, Yang et al., realizaron un estudio para caracterizar cepas de
E. coli multirresistentes aisladas en pollos31, obteniendo un 100 % de resistencia a NAL,
98 % a tetraciclina, 79% a ampicilina,
77 % a estreptomicina y el 76 % a trimetoprima
sulfametoxazol. También se detectó resistencia a
fluoroquinolonas, tales como levofloxacina y ciprofloxacina. Asimismo, Camacho et al. realizaron
un estudio en México para detectar Salmonella
spp. en muestras de pollo, donde evaluaron la resistencia a 18 antimicrobianos7
. Las mayores resistencias se observaron con cefalotina, amoxicilina más ácido clavulánico, cefoxitina, y ampicilina,
todos ellos pertenecientes al grupo de los betalactámicos. En Venezuela, Briceño et al. evaluaron la
resistencia a fluoroquinolonas en Salmonella spp.,
aisladas en el procesamiento de pollo entero6
, que
evidenciaron un alto porcentaje de resistencia
a NAL (73 %) y baja resistencia (3 %) a CIP. En
nuestro estudio, la única cepa de Salmonella spp.
fue resistente a CIP.
De los 93 aislamientos analizados en
nuestro trabajo (53 E. coli, 39 E. faecalis y una
Salmonella spp), 30 presentaron resistencia a antimicrobianos: 15 fueron resistentes sólo a una
clase de antimicrobianos, y 15 fueron resistentes
a 2 clases. El perfil más prevalente en E. coli fue
la sensibilidad disminuida a CIP. Cinco aislamientos (9,4 %) fueron resistentes a cefalosporinas de
tercera generación por producción de BLEE. Esto
es de gran importancia ya que éstas son enzimas
producidas por bacilos Gram negativos y confieren
resistencia a la mayoría de los antibióticos betalactámicos1
. Estas bacterias se aislaron principalmente en muestras de frigorífico y no se detectaron en
muestras de granja. Estos resultados difieren de un
estudio en China que reportó un 25 % de prevalencia de E. coli BLEE en pollos17. La resistencia a COL
fue muy baja, observándose sólo en 2 aislamientos
obtenidos de granja. Por otro lado, Novais et al.,
llevaron a cabo un estudio prospectivo en pollos
entre los años 1999 a 2001 en Portugal determinando la presencia de Enterococcus spp. resistentes a diferentes antibióticos21, hallando resistencia
a VAN en un 48 %, y a otros antimicrobianos tales
como gentamicina, estreptomicina y kanamicina.
En nuestro trabajo no se detectaron aislamientos
de enterococos resistentes a VAN.
Se considera que la exposición prolongada a dosis bajas de antimicrobianos (por ej. contenido en alimentos) tiene mayor probabilidad
de dar origen a la aparición de resistencia que el
tratamiento o la prevención de infecciones en los
animales30. En este sentido, y en el marco de la
lucha contra la RAM, el SENASA ha prohibido los
registros y certificados de uso y comercialización
de alimentos con antibióticos para animales desde
principios del 201925. La aparición de resistencia
es una preocupación a nivel mundial en la salud
humana y animal. Por este motivo, la acción coordinada entre ambos sectores es fundamental para
preservar la eficacia terapéutica de los tratamientos utilizados en infecciones humanas a futuro22.
CONCLUSIONES
La entrada de patógenos en la cadena alimentaria representa un riesgo para los consumidores y, desde el punto de vista de la salud pública,
esta situación se ve agravada por la presencia de
cepas resistentes a antimicrobianos. Los resultados
de este estudio revelan la necesidad de intensificar
los controles higiénico-sanitarios en la cadena de
manipulación de las aves, e implementar mejoras
para la reducción de patógenos en carne de pollo.
El compromiso con la salud pública de los
gobiernos a nivel global, debe fortalecerse a través
de la ejecución de mecanismos de vigilancia, regulación, fiscalización, capacitación, investigación y
promoción social, para lograr prevenir y controlar
el avance de la resistencia antimicrobiana.
1. Abreu, R; Castro Hernández, B; Madueño, A. et al. Prevalencia de cepas de Escherichia coli productoras de betalactamasas de espectro extendido (BLEE) aisladas en pollos de
granjas avícolas de la isla de Tenerife (España). Higiene y
Sanidad Ambiental. 2013; 13 (4): 1091-1096.
2. Adeyanju, G; Ishola, O. Salmonella and Escherichia coli contamination of poultry meat from a processing plant and
retail markets in Ibadan, Oyo State, Nigeria. Springer plus.
2014; 3, 139.
3. Aidara-Kane, A. Containment of antimicrobial resistance
due to use of antimicrobial agents in animals intended for
food: WHO perspective. Revue Scientifique et Technique (International Office of Epizootics).2012; 31: 277-287.
4. Ardoino, S.; Toso, R.; Toribio M. et al. Antimicrobianos como
promotores de crecimiento (AGP) en alimentos balanceados para aves: uso, resistencia bacteriana, nuevas alternativas y opciones de reemplazo. Ciencia Veterinaria. 2017; 19:
50-66. En: http://dx.doi.org/10.19137/cienvet-20171914
5. Audisio, M.C. 2007. Aves. pp 117-124. En: Carrillo (ed). Manual de Microbiología de los Alimentos. Facultad de Ciencias Agrarias, UNJU, SS Jujuy.
6. Briceño-Torres L.; Narváez-Bravo, C.; Rodas-González A.:
Wittum, T.; Hoet, A. Resistencia a las fluoroquinolonas y
otros antimicrobianos en cepas de Salmonella spp. aisladas en el procesamiento de pollo entero. Revista Científica.
2007; 17: 521-528.
7. Camacho, O.; Acedo, L.; Moreno, G.; Sánchez, R.; Castillón,
L. et al. Detección de Salmonella resistente a los antibióticos en vísceras de pollo. Biotecnia. 2010; 12: 3-11.
8. CLSI, Clinical and Laboratory Standards Institute. (2018).
Performance Standards for Antimicrobial Susceptibility
Testing; 28th Informational Supplement; CLSI Supplement
M100-S24; Wayne, PA, USA.
9. CoNaCRA, Comisión Nacional para el Control de Resistencia Antimicrobiana. Resistencia Antimicrobiana, 2019. En:
https://www.paho.org/arg/index.phpoption=com_docman&view=download&alias=415-resistencia-antimicrobiana&category_slug=epidemiologia-prevencion-y-control-de-enfermedades&Itemid=624
10. Errecalde, J. O. (2004). Uso de antimicrobianos en animales de
consumo. Incidencia del Desarrollo de Resistencia en la salud
pública. Ed: FAO 2004. Roma, Italia.
11. Food and Agriculture Organization of the United Nations.
Gateway to poultry production and products, 2020. En:
http://www.fao.org/poultry-production-products/production/en/
12. Genta, G.; Bueno D. Salmonella en granjas de pollos parrilleros
de la provincia de Entre Ríos. Presentación en el XIII Congreso
Argentino de Microbiología 2013. Revista Argentina de Microbiología. 2013; 45: 84.
13. Huertas Moreno, A. 2018. Evaluación cualitativa de riesgos
en una cadena productiva de pollo y sus relaciones con el
eje de inocuidad de la Seguridad Alimentaria y Nutricional.
Trabajo Final de Maestría. Facultad de Medicina. Colombia.
14. ISO, International Organization for Standardization. 2000.
Water quality - Detection and enumeration of intestinal enterococci- Part 2: Membrane filtration method. En: https://
www.iso.org/standard/14854.html
15. ISO, International Organization for Standardization. 2017.
Microbiology of the food chain. Horizontal method for the
detection, enumeration, and serotyping of Salmonella. Part
1: Salmonella spp detection. En: https://www.iso.org/
standard/56712.html
16. ISO, International Organization for Standardization. 2018.
Microbiology of the food chain. Horizontal method for enumeration of Escherichia coli beta-glucuronidase positive.
Part 1: Colony counting technique at 44 degrees C using
membranes and 5-bromine-4-chloro-3-indol beta-D-glucuronide. En: https://www.iso.org/standard/64951.html
17. Li, J.; Ma, Y.; Hu, C. et al. Dissemination of cefotaxime-M-producing Escherichia coli isolates in poultry farms, but not
swine farms, in China. Foodborne Pathogens and Disease
2010; 7: 1387-1392.
18. López, A.; Burgos, T.; Díaz, M.; Mejía, R; Quinteros, E. Contaminación microbiológica de carne de pollo en 43 supermercados de El Salvador. ALERTA: Revista Científica del
Instituto Nacional de Salud de El Salvador. 2018;1(2, 45-53.
En: https://doi.org/10.5377/alerta.v1i2.7134
19. Mercado, M.; Avila, J.; Rey, M. et al. Brotes por Salmonella
spp., Staphylococcus aureus y Listeria monocytogenes asociados al consumo de pollo. Revisión sistemática de la literatura. Biomédica. 2012; 32(3): 375–385. En: https://doi.
org/10.7705/biomedica.v32i3.697
20. Navarro, F.; Calvo, J.; Cantón, R.; Fernández-Cuenca,
F.; Mirelis, B. Detección fenotípica de mecanismos de
resistencia en microorganismos gramnegativos. Enfermedades Infecciosas y Microbiología Clínica. 2011;
29: 524-534.
21. Novais, C.; Coque, T.; Costa, M.; Baquero, F.; Peiye, L. High
occurrence and persistence of antibiotic-resistant enteroccocci in poultry food samples in Portugal. Journal of Antimicrobial Chemotherapy. 2005; 56:1139-1143.
22. OIE, Organización Mundial de la Salud Animal. Estrategia de la OIE sobre la resistencia a los agentes antimicrobianos y su uso prudente. Noviembre 2016;[12
pantallas]. En: https://www.oie.int/fileadmin/
Home/esp/Media_Center/docs/pdf/PortalAMR/ES_
OIE-AMRstrategy.pdf
23. Oliver, A; Cantón, R. Enterobacterias productoras de
β-lactamasas plasmídicas de espectro extendido. Control
calidad SEIMC. 2004. p. 1-2.
24. Sanchez Bruni, S. F. Caracterización y control de resistencia
antimicrobiana: un desafío interdisciplinario integrado. Ciencia e Investigación. 2015; 65 Nº 4
25. SENASA, Servicio Nacional de Sanidad y Calidad Agroalimentaria. Resolución 1119/2018. Boletín Oficial de la República Argentina. Diciembre 2018. En: https://www.boletinoficial.gob.ar/detalleAviso/primera/199463/20190103
26. SENASA, Servicio Nacional de Sanidad y Calidad Agroalimentaria. 1995. Resolución 198/95.Art14,AnexoII.1995.
En: http://www.loa.org.ar/leg/Anexo%20RE-198-1995-
SENASA.pdf
27. Uddin, J.; Hossain, K.; Hossain, S. et al. Bacteriological assessments of foodborne pathogens in poultry meat at different super shops in Dhaka, Bangladesh. Italian Journal of
Food Safety, 2019; 8:1.
28. USDA, United Stated Department of Agriculture 1996. Guidelines for Escherichia coli Testing for. Process Control Verification in Poultry Slaughter Establishments. En: https://
www.fsis.usda.gov/wps/wcm/connect/3efc7f8e-e6a2-49
97-91ba-9c579c2a1f14/Guideline_for_Ecoli_Testing_Slaughter_Estab.pdf?MOD=AJPER ES
29. WHO, World Health Organization. 2018 Resistencia a los
Antibióticos. Disponible en: https://www.who.int/es/
news-room/fact-sheets/detail/resistencia-a-los-antibi%-
C3%B3ticos.
30. WHO, World Health Organization. 2008 Resistencia a los
antimicrobianos transferida por animales productores de
alimentos. En: https://www.who.int/foodsafety/fs_management/No_02_Antimicrobial_Mar08_E S.pdf
31. Yang. H.; Chen S.; While, D. et al Characterization of multiple antimicrobial- resistant Escherichia coli isolates from
diseased chicken and swine in China. Journal of Clinical Microbiology 2004; 42: 3483-3489.