Tabla 1:: Contaminación de STEC en alimentos
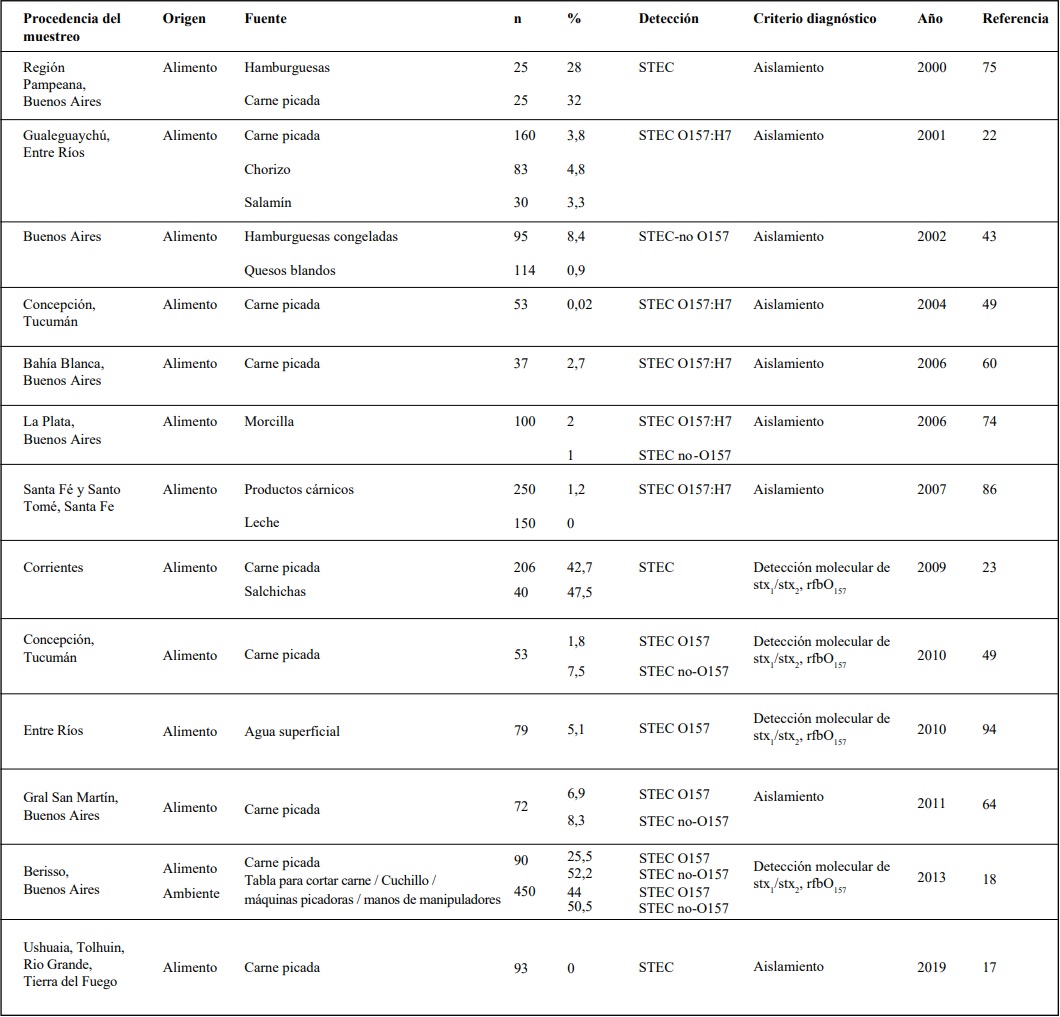
Nota: Debido a que los métodos de análisis fueron modificándose y los criterios son diferentes, el ordenamiento de la tabla es cronológico
REVISIÓN BIBLIOGRÁFICA
Estudio de reservorios, portadores y fuentes de infección de Escherichia coli shigatoxigénico en diversos contextos geopolíticos de Argentina
Bonino, MP1,2; Broglio, A1,2; Sanin, M1; Cundon, C1; Rumi, MV1; Blanco Crivelli, X1; Bentancor, A1
1
Universidad de Buenos Aires, Facultad de Ciencias Veterinarias, Microbiología.
2
Consejo Nacional de Investigaciones
Científicas y Técnicas.
Recibido: 15/07/2021
Aceptado: 03/12/2021
Correspondencia e-mail:Adriana Bentancor aben@fvet.uba.ar
Resumen
Entre los patógenos zoonóticos de transmisión alimentaria Escherichia coli shigatoxigénico (STEC) tiene un gran impacto en el sistema de salud. STEC es responsable de diversos cuadros clínicos diarreogénicos que pueden progresar a síndrome urémico hemolítico (SUH). El SUH es una enfermedad endémica en Argentina que afecta principalmente a niños menores de 5 años y puede causar la muerte del paciente. Los serogrupos con mayor prevalencia clínica en nuestro país son O157, O145, O121, O26 y O174. Los bovinos constituyen el principal reservorio del patógeno. La ruta fecal–oral, asociada a la contaminación de alimentos, principalmente carne o agua, se considera la principal vía de trasmisión de STEC. Sin embargo, las cepas de impacto clínico coinciden parcialmente con las aisladas en bovinos por lo que toma importancia el estudio de reservorios, portadores y fuentes de infección. En áreas urbanas, se investigó el rol de los animales de compañía y de especies sinantrópicas en la epidemiología de SUH. Se determinó la prevalencia por especie (caninos 1,1 %, felinos 2,6 % y Rattus spp. 0 %). El estado de portador de animales convivientes y sinantrópicos vinculados con casos clínicos de SUH establecido fue 10 %, 33 % y 11,7 % en caninos, felinos, y Rattus spp. respectivamente. Debido a una mayor incidencia constante de SUH en la región sur de Argentina, se inició un estudio de reservorios y fuentes de infección en Tierra del Fuego. La contaminación de STEC en carne de expendio minorista fue escasa. En el análisis de bovinos y ovinos en playa de faena los serogrupos prevalentes fueron O174 y O178. No se detectó STEC O157 en las muestras analizadas. El estudio de los diferentes eslabones de la cadena epidemiológica de STEC es necesario para comprender la dinámica de la enfermedad en diferentes contextos geopolíticos a fin de establecer acciones preventivas para disminuir su prevalencia.
Palabras clave: zoonosis, diarreas, SUH, STEC
Study of reservoirs, carriers, and sources of infection of Shiga toxin-producing Escherichia coli in different geopolitical contexts of Argentina
Summary
Shiga toxin-producing Escherichia coli (STEC) is a zoonotic foodborne pathogen that has a great impact on the health system. STEC is responsible for various diarrheagenic clinical symptoms that can progress to hemolytic uremic syndrome (HUS), which can lead to death. HUS is an endemic disease in Argentina, and children under five years old are the vulnerable population affected. The serogroups with the highest clinical prevalence in our country are O157, O145, O121, O26, and O174. Cattle are the main reservoir of STEC. The main mode of transmission is the fecal-oral route, associated with contaminated food, especially meat or water. However, the strains with clinical impact partially coincide with those isolated from cattle, which is why the study of reservoirs, carriers, and sources of infection is important. We investigated the role of domestic and synanthropic animals from urban areas in the epidemiology of HUS. The prevalence was 1.1 % (dogs), 2.6 % (cats), and 0 % (Rattus spp.). The carrier status associated with HUS clinical cases was 10% (dogs), 33 % (cats), and 11.7 % (Rattus spp.). Due to a constant higher incidence of HUS in the southern region of Argentina, we initiated a study of reservoirs and sources of infection in Tierra del Fuego. STEC contamination in retail meat was low. The analysis of cattle and sheep slaughtered in abattoirs showed O174 and O178 as the main serogroups. STEC O157 was not detected. The study of the chain of infection of STEC is necessary to understand the dynamics of the disease in different geopolitical contexts and to establish preventive actions to reduce its prevalence.
Key words: zoonosis, diarrhea, HUS, STEC
INTRODUCCIÓN
Entre los agentes etiológicos más frecuentemente asociados a las diarreas se destaca Escherichia coli, microorganismo que forma
parte de la microbiota normal del intestino del
hombre y animales de sangre caliente31. Las cepas de E. coli diarreogénicas (DEC) incluyen los
patovares E. coli shigatoxigénico o verotoxigénico (STEC/VTEC), E. coli enteropatógeno (EPEC),
E. coli enteroagregativo (EAEC), E. coli enteroinvasivo (EIEC), E. coli enterotóxico (ETEC) y E. coli
de adherencia difusa (ECAD). También se describen híbridos cuyo potencial patógenoes alto tales
como EAEC-EPEC y EAEC-ETEC aislados de casos
clínicos de niños10,35,44,73. En Argentina, en 2014,
se describió STEC-EAEC en un caso de diarrea21.
La información epidemiológica de la distribución
de cada patógeno es relevante en el contexto de
la interfase humano-animal-ambiente19.
E. coli puede modificar su virulencia mediante adquisición de elementos genéticos móviles,
así como a partir de mutaciones espontáneas que
serán eficientes en la medida que le den una ventaja adaptativa a su entorno, biótico o abiótico100.
STEC produce desde diarreas leves a graves generalmente sanguinolentas con compromiso renal
y/o neurológico que pueden ocasionar la muerte
del paciente. Por su ciclo de infección se vincula a
zoonosis transmitida por alimentos (ZTA), asociada
a la ingestión de agua o alimentos, probablemente
contaminados con materia fecal de portadores45. Se
asume que el reservorio principal son los rumiantes, destacándose el rol de los bovinos y ovinos8
.
STEC, patógeno emergente con presentación endémica en la Argentina, determina
intensos estudios por su morbi-mortalidad de
implicancia en la Salud Pública. Desde el descubrimiento de este grupo de bacterias se ha estudiado
exhaustivamente aspectos específicos de la toxina,
su estructura y función, la interacción con los receptores celulares del huésped y los aspectos clínicos de la enfermedad97,98. El principal factor de
virulencia es la toxina Shiga (Stx)54. Se reconocen
dos tipos de toxina, Stx1 y Stx2, pero no todas las
cepas codifican ambas76. Además, existen factores adicionales, como adhesinas, proteasas, otras
toxinas, que contribuyen a que progrese la infección31. La habilidad de colonizar el intestino es un
paso clave para el desarrollo de enfermedad.
Los factores de virulencia plasmídicos
descriptos incluyen el locus de la enterohemolisina (ehx) y el sistema de secreción tipo II. Por otro
lado, se detectó el locus LEE (locus de esfacelación
del enterocito) donde se encuentran, entre otros, el
gen eae que codifica la proteína de adherencia intimina, un sistema de secreción de tipo III, y Tir (el
receptor de intimina traslocable). La unión intimina-Tir desencadena la polimerización de la actina
responsable de la lesión de unión y esfascelación,
denominada “attaching and effacing” (A/E)31.
En las cepas LEE-negativas, otros factores
de adherencia (Saa, Iha, Lpf y ToxB) estarían involucrados en la patogénesis. Sin embargo, los mecanismos de adhesión y colonización en las cepas
LEE-negativas aún no están claramente determinados32,71. En 2017, Montero y col., identificaron una
isla de patogenicidad a la que denominaron locus
de adhesión y autoagregación (LAA) que sólo se encuentra presente en cepas LEE-negativas70.
Se describen varios subtipos de toxina
Shiga con diferente potencial patogénico, de los
que se destacan por asociarse a cuadros clínicos
graves Stx2a, Stx2c y un subtipo de Stx2 activable
por mucus intestinal (Stx2dactiv o Stx2d)91 .
Los serotipos relacionados con enfermedad en el humano varían entre los diferentes
países y a través de los años50,52,53. En Argentina,
el serotipo más frecuente es O157:H779, cuyo perfil genotípico predominante es stx2a/stx2c seguido
por el stx2a
97. Se reportó en la región sur del país
la circulación de STEC O157 pertenecientes al clado 8 caracterizado por ser hipervirulento, con el
perfil stx2a/stx2c/eae/ehxA77. Estas cepas son responsables de una enfermedad más severa, de progresión rápida, muchas veces fatal58. Más de 400
serotipos de E. coli pueden presentar la información necesaria para sintetizar la toxina Shiga. Además de O157, existen otros serogrupos implicados
en brotes importantes de enfermedad en humano
que han sido denominados por los norteamericanos como “Big Six”, e incluyen O26, O45, O103,
O111, O121 y O145, los cuales se caracterizan por
ser stx/eae positivos1
. El perfil más frecuente entre las cepas STEC no-O157 es stx2a/eae/ehxA80.
El diagnóstico durante la primera fase de
diarrea, al no ser específico, puede ser inadvertido
y es frecuente que se detecte el agente etiológico
recién una vez establecido el SUH77.
Con el fin de proteger a los consumidores
de posibles enfermedades transmitidas por alimentos (ETA) por serogrupos STEC no-O157, el
Código Alimentario Argentino (CAA)26 incorporó
criterios microbiológicos para dichos serotipos en
los artículos 156 tris, 255, 302 y 925 quáter respectivamente26. Para el diagnóstico en alimentos
se han desarrollado varios protocolos que incluyen el rastrillaje por sistemas comerciales (BAXR
Real Time PCR) y el uso de inmunocaptura específica37,38. En este sentido, existen protocolos de
múltiple PCR que permiten el reconocimiento de
los serotipos más frecuentes92. Particularmente,
en Argentina, los serotipos O157:H7/NM son responsables del 70% de los casos clínicos80 y entre
los serogrupos no-O157 se aislaron con mayor frecuenciaO26, O145, O121 y O17479. El aislamiento
y caracterización de cada cepa permite considerar
su riesgo potencial. Existen métodos desarrollados para comparar los clones circulantes, PFGE,
y establecer el riesgo molecular (MRA) utilizando
MLST, SNP, PCR-BIT16,30.
EPIDEMIOLOGÍA
La epidemiología de diarreas y SUH se
vincula a ETA y, en menor medida, a la transmisión
persona-persona o contacto directo con animales.
En 1982, Riley refiere el primer brote asociado a
alimentos contaminados85. Al momento se reconoce una amplia gama de casos asociados a STEC,
con cuadros que cursan desde asintomáticos a
diarreas acuosas o hemorrágicas. En el 5-15% de
los pacientes, la infección progresa a un cuadro de
SUH con un fallo renal agudo en 20 a 35% de los
casos, a corto o largo plazo31. La franja etaria de
mayor incidencia está compuesta por niños menores a 5 años97 y, en algunos casos, ancianos, posiblemente debido a inmadurez inmunológica e insuficiencias inmunológicas, respectivamente31,51.
Aproximadamente un 30% de supervivientes sufren diversas secuelas permanentes incluyendo
insuficiencia renal crónica, hipertensión y desórdenes neurológicos51,93,95.
La transmisión persona-persona ha sido
documentada durante los brotes61, incluso la exposición en enfermeras y microbiólogos ha sido
identificada como causa de infección27. El período
promedio de eliminación por materia fecal en niños de 5 años es de 17 días a partir de la remisión
de los síntomas. Se ha demostrado que otros miembros de la familia involucrada en el brote pueden
padecer una infección asintomática o con síntomas
gastrointestinales la semana previa o simultáneamente al cuadro de SUH61,83. La transmisión persona-persona o a través del agua sugiere una muy
baja dosis infectante. Esta característica ha sido
confirmada por recuento de UFC a partir de alimentos involucrados en brotes donde la dosis infectante fue estimada en 50 microorganismos61. La OMS
ha reforzado la vigilancia de SUH en el cono sur,
con sitios centinelas en Argentina, Chile, Paraguay
y Bolivia; y ha designado a las cepas STEC como
marcadores en trazas de ETA. A su vez, Brasil debido al incremento de SUH, ha iniciado un sistema de
vigilancia nacional99.
En Argentina, durante el período 2011-
2015, se notificaron 1.953 casos de SUH66 y 884
casos en el período 2014-201867. La enfermedad
presenta una distribución estacional con mayor casuística en primavera – verano68 y una distribución
de casos diferencial, ya que en la zona sur del territorio argentino se registran los índices más altos.
En 2019, las tasas más elevadas de SUH
se mantuvieron en la Región Sur con el mayor número de casos notificados del país en Tierra del
Fuego (TDF)67,68. Dentro de TDF, Ushuaia presentó
las tasas más elevadas los años 2013 y 2017 (6,2
casos/100.000 hab. y 5,6 casos/100.000 hab., respectivamente), por lo que se infiere que la tasa de
notificación provincial fue traccionada por los valores de este departamento (Estudio Multicéntrico, Ministerio de Salud, NRU 2765)42,69.
A partir de los brotes por consumo de
hamburguesas contaminadas con E. coli O157:H7
en 1993 y 1994 en USA los estudios se enfocan
en el alimento como fuente de infección. Las rutas de transmisión cobran importancia con relación a la estrategia de control98. Al día de hoy, las
fuentes de infección de las cepas que provocan
SUH en la Argentina son diversas. El ganado ha
sido señalado como el principal reservorio de cepas STEC, incluyendo los serotipos relacionados
con O157:H711,25,39,46,48,62. También han sido halladas en mascotas clínicamente sanas como gatos,
perros y conejos 2,4,5,8,51,55,87. Mediante estudios
realizados en la ciudad de La Plata, en animales silvestres asentados en zoológicos, se pudo
constatar la diversidad de cepas presentes y se
comprobó que distintas especies animales compartían la misma cepa56.
STEC EN ALIMENTOS
Potencialmente, el vehículo para STEC
son los alimentos crudos o elaborados; posiblemente contaminados en algún punto de su proceso con materia fecal de animales portadores, incluyendo las contaminaciones asociadas a malas
prácticas de faena62.
El grado de contaminación de la carne y
subproductos ha sido estudiado por diversos grupos en Argentina, incluyendo el nuestro. Se destacan los estudios de prevalencia de STEC O157
y no-O157, en distintas etapas de la cadena de
producción de productos cárnicos. Si bien se observan diferencias en las metodologías, existen
relevamientos realizados en diversas provincias
del país donde se evaluó la contaminación con resultados variables (Tabla 1). Los estudios buscan
identificar las variables asociadas a la cadena de
comercialización de la carne.
Se ha sugerido que la mayor incidencia de
la enfermedad en nuestro país se debe al mayor consumo de carne vacuna per cápita, que alcanzó 60
kg/persona/año, o a la transmisión persona-persona o animal-persona. La alimentación también fue
señalada como factor de riesgo para los animales
de compañía portadores de cepas STEC4
. La evaluación del grado de contaminación de la carne de
expendio minorista cuenta con pocos estudios sistemáticos y las prevalencias son muy variables.
Bajo el criterio de contaminación de la
carne en la faena debe contemplarse el impacto
del sistema productivo de los animales, a campo
o feedlot47. Se ha determinado una mayor prevalencia de STEC en animales en feedlot, por lo que
esa carne ofrece mayores riesgos. La misma se distribuye principalmente en áreas de CABA y Gran
Buenos Aires, generalmente de mayor nivel adquisitivo. La faena de animales de feedlot representa
18 al 21% del total nacional, que se distribuye mayoritariamente en la región bonaerense47. Si bien
esta distribución podría relacionarse con diferencias de contaminación según diferentes criterios,
no existen estudios metódicos que demuestren diferencias significativas en la contaminación de la
carne de expendio. Estudios previos indican que,
en un modelo restringido a nivel socioeconómico,
el grado de contaminación difiere según las áreas,
siendo menor en aquellas provenientes de nivel
socioeconómico alto20,89.
La distribución de casos de SUH en la región bonaerense no es uniforme. La enfermedad
cuenta con notificación obligatoria semanal y personalizada (Sistema Nacional de Vigilancia en Salud) en la cual se identifica el domicilio de los casos. Avances en la georreferenciación de los casos
de SUH en CABA57,87 dieron evidencia de áreas de
riesgo epidemiológico donde la presentación de casos tiene asociación estadística6
. Se ha investigado si estas áreas coinciden con comercios minoristas
de carne con mayor grado de contaminación o si las
buenas prácticas se cumplen correctamente en las
diferentes bocas de expendio de esas áreas18,64.
Al analizar regiones de alta incidencia
de SUH, como lo es TDF, se georreferenciaron y
muestrearon todas las carnicerías habilitadas
de la región Argentina de la Isla. Este constituyó
el primer análisis de la posible contaminación
de alimentos con cepas STEC en el área. Los resultados obtenidos, demostraron que la contaminación por STEC en carne de expendio minorista fue escasa y no se detectó STEC O157 en
las muestras analizadas17.
Tabla 1:: Contaminación de STEC en alimentos

Nota: Debido a que los métodos de análisis fueron modificándose y los criterios son diferentes, el ordenamiento de la
tabla es cronológico
STEC EN RUMIANTES
La prevalencia de STEC en la materia fecal del ganado y en carcasas es altamente variable,
y depende de la región, tipo de animal, edad, estación del año, entre otros factores. La mayoría de los
reportes indican un aumento en la casuística de infección por STEC en época estival81 y se ha demostrado que la prevalencia en bovinos fluctúa durante
el año llegando a los niveles más altos en verano36,84.
Asimismo, se señaló que el riesgo de infección en el
hombre aumenta en primavera-verano, al igual que
el aumento de la prevalencia de STEC en el ganado81.
Diversos estudios indican que la mayoría del
ganado ha estado expuesto a cepas STEC en algún momento de sus vidas 9,75. Nuestros estudios sobre bovinos permitieron identificar las diferentes prevalencias
según el contexto de origen (Tabla 2). Las características ganaderas de la Isla de TDF con una producción de
ciclo completo que autoabastece el mercado local difieren respecto a las continentales. La importación desde
el norte del Río Colorado, en el área continental, solo
permite cortes enteros envasados al vacío, sin hueso.
En el estudio de bovinos de esta región no se detectó
STEC O157, pero se aisló STEC O174 entre los serogrupos no-O157, el cual es de impacto local15,29.
Si bien se hipotetizó que la casuística en
Argentina se debía al consumo de carne vacuna,
la región patagónica del país, especialmente TDF,
cuenta con el mayor consumo de carne ovina de
todo el país, alcanzando 25-30kg/habitante/año.
De las dos regiones patagónicas definidas por el
Ministerio de Agroindustrias, la Patagonia Sur
(Chubut, Santa Cruz y TDF) es la más relevante
para la producción ovina ya que concentra el 48
% del stock ovino nacional65. En TDF el 83% de los
productores posee más de 1.000 cabezas ovinas
y el 90% del stock ovino se encuentra en grandes
majadas (de 5.000 hasta 60.000 animales), lo cual
no ocurre en el área continental del país65. Se ha
observado que la prevalencia de STEC en corderos
de TDF superó a la bovina de la isla y, al igual que
en dicho muestreo, se detectó ausencia de cepas
STEC O157 y se aisló el serogrupo O17414.
Tabla 2:: Detección de STEC en rumiantes
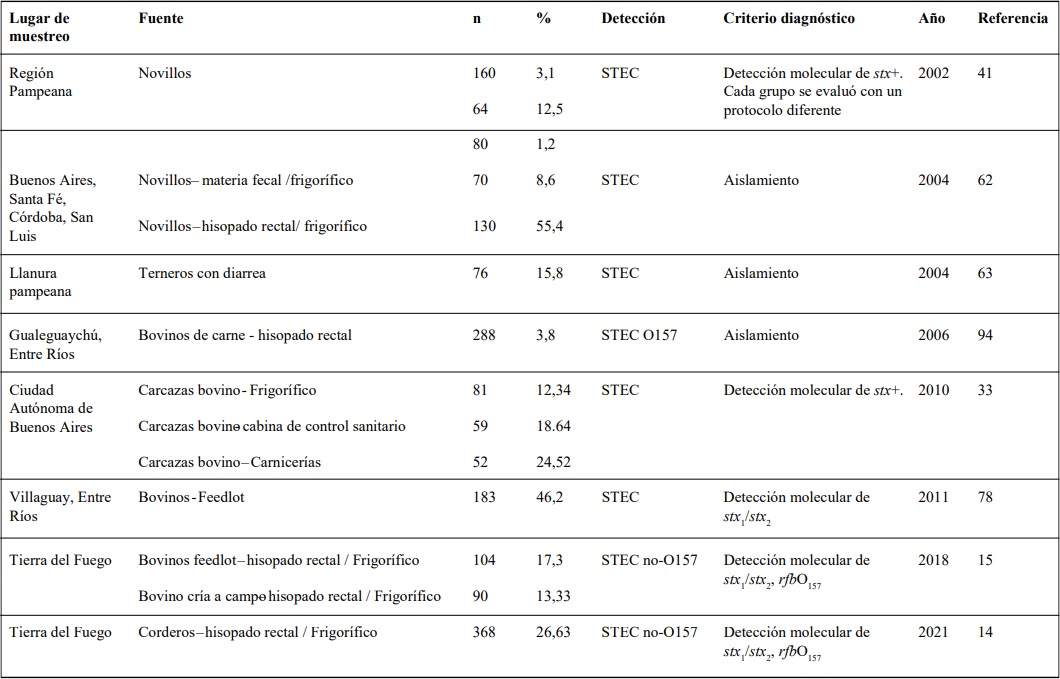
Nota: Debido a que los métodos de análisis fueron modificándose y los criterios son diferentes, el ordenamiento de la tabla es cronológico
STEC EN PERROS Y GATOS
E. coli es un constituyente importante de
la microbiota intestinal del perro y del gato e involucra, entre otras, las cepas STEC31. La prevalencia
determinada en nuestro país en animales de compañía es compatible con la Europea y presenta variaciones estacionales2,7 (Tabla 3). Se ha observado
una relación entre el riesgo de ser hospederos de
cepas STEC, el alimento de las mascotas y las actitudes familiares, que permite inferir que los animales
tienen el mismo rol epidemiológico que el humano.
En un trabajo colaborativo con el Departamento de Epidemiología de CABA, se analizó la portación de STEC en los animales de compañía convivientes con casos clínicos de SUH88. Se intervino en 28
casos de SUH y 49 de diarreas agudas sanguinolentas
(DAS) con rastrillaje de STEC por PCR a partir de hisopados rectales de los animales relacionados al foco
reportado. Se observó un incremento en el porcentaje de animales portadores de STEC en los animales
relacionados a casos de SUH, respecto a la prevalencia local (Tabla 3). En un estudio de brote se detectó un gato doméstico asintomático portador de una
cepa STEC de alta virulencia, como lo es O145:NM
stx290. Este serotipo está asociado a casos de SUH en
nuestro país y es el más frecuente dentro del grupo
de las STEC no-O157. En el mismo contexto del brote, otro animal de la familia, un perro, fue detectado
como portador de una cepa O178:H19 stx2(vha)
, lo cual
permitió inferir que los animales de compañía probablemente estén expuestos a las mismas fuentes de
infección que los humanos90. Las cepas STEC circulan
en los animales que conviven o tienen al menos un
hábitat compartido con la población en riesgo80,81,87,90.
STEC EN SINANTRÓPICOS
En la problemática de las enfermedades
zoonóticas deben ser considerados, además del agente causal, el ambiente y el huésped susceptible, las diferentes especies animales que pueden actuar como
reservorios haciendo posible que la etiología de la enfermedad persista en el ambiente. Tanto animales domésticos como no domésticos pueden ejercer ese rol
dentro de la cadena epidemiológica de una zoonosis.
De los animales no domésticos que comparten el área
de asentamiento con el hombre, es decir sinantrópicos, se estudió el estado de portación en murciélagos
frugívoros y en roedores recolectados en CABA (Tabla
3). El relevamiento de murciélagos arrojó resultados
negativos para la portación de STEC96, coincidente
con la baja carga de E. coli informada en esta especie.
En lo que a roedores respecta, el género
Rattus constituye un grupo de interés debido a que
habita en áreas urbanas compitiendo por fuentes de
alimentación con el ser humano, incluso en condiciones ambientales desfavorables como cámaras frigoríficas si encuentra alimento disponible. Existen pocos
reportes previos respecto a Rattus spp. y los mismos
refieren a animales capturados en áreas rurales. Se
identificaron aislamientos que compartían el mismo
patrón de PFGE entre cepas del ganado y Rattus norvegicus en una granja de Dinamarca72.
En la República Checa, se detectó O157 en 4/10 R. norvegicus, alcanzando una prevalencia similar a la del ganado en
feedlot24. Sin embargo, el serogrupo no establece de
por si el potencial patógeno de la cepa, ya que serotipos tales como O157:H16 no presentan los genes de
toxina Shiga y son categorizadas como EPEC31.
Tabla 3:: Detección de STEC en animales de compañía y sinantrópicos
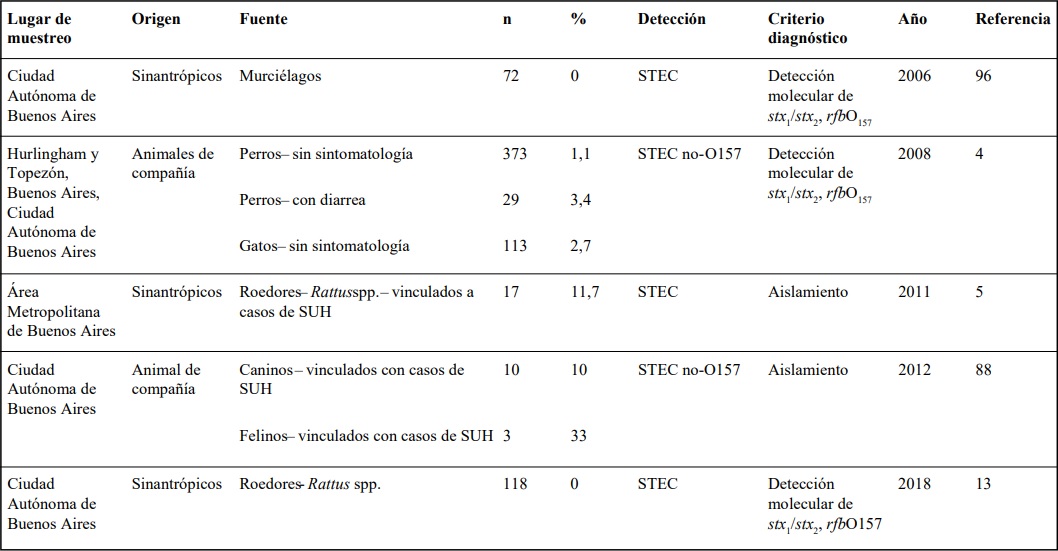
Nota: Debido a que los métodos de análisis fueron modificándose y los criterios son diferentes, el ordenamiento de la tabla
es cronológico
Los estudios de estos roedores relacionados con casos de SUH, permitieron identificar Rattus rattus STEC positivos, constituyendo el primer reporte de R. rattus portadores de STEC a nivel mundial12. Asimismo, al evaluar las georreferencias de casos de SUH y DAS en CABA, se observó asociación estadística significativa entre algunos clusters, y la presencia de ríos subterráneos y vías férreas, posible hábitat de especies de este género6,57. El aislamiento de una cepa STEC O174:H21 stx2c(vh-b) de R. rattus fue comparado con cepas del mismo serogrupo aisladas de otras fuentes de la región (casos clínicos, alimentos, bovinos) y se determinó mediante PFGE un 93,7 % de similitud con un aislamiento bovino y, mayor al 75 % respecto a aislamientos humanos29. Todos los aislamientos O174:H21 analizados pertenecieron al secuenciotipo ST 8928.
SITUACIÓN DE SUH EN LA ARGENTINA
El SUH fue descrito en nuestro país desde 196440. Si bien la distribución geográfica mundial de SUH se caracteriza por una mayor prevalencia en las zonas templado-frías, Argentina es el país donde se registra la mayor incidencia. El número de casos nuevos por año ha llegado a superar en 2008 los 450 con un número importante de subregistros80,82. Actualmente, el sistema de notificación ha sido revisado, los métodos de diagnóstico mejorados y los controles en la cadena alimenticia han permitido disminuir sensiblemente la casuística de la enfermedad. En 2019, se notificaron 220 casos de SUH (SE1 a SE34)68. El SUH, endémico en el país, presenta mayor incidencia en las provincias del sur, describiéndose casos durante todo el año, con mayor prevalencia durante los meses cálidos. La mayor incidencia se observa en niños entre 6 y 36 meses, sin diferencias por sexo. La etiología local de los cuadros de SUH corresponde en el 60 % de los casos a cepas STEC79. Entre 1965 a 1995, el Comité de Nefrología informó un total de 7.000 casos. En abril del año 2000 el Ministerio de Salud (Res. 346/00) estableció la notificación obligatoria al Sistema Nacional de Vigilancia Epidemiológica (SINAVE). Esta ley alcanza sólo a los centros públicos de atención y no obliga a los centros privados a su notificación. Los convivientes de los pacientes con SUH suelen ser portadores83, incluyendo animales de compañía, que en los casos de SUH analizados tuvieron un estado de portador de cepas STEC superior respecto a la prevalencia de esa población para la misma área3,5,87.
CONSIDERACIONES EN SALUD PÚBLICA
La problemática SUH engloba muchas variables dentro de las que se conjugan las del huésped, ambiente y agente. Los riegos de la producción animal para la salud pública dependen de la prevalencia, incidencia y variedad de patógenos en los animales, así como el grado de interacción entre el animal y el hombre59. El ganado bovino es un reservorio natural de serogrupos de STEC O157:H7 y no-O15743 con prevalencias elevadas en producciones de feedlot97.
DISCUSIÓN Y CONCLUSIONES
Al realizar la anamnesis de pacientes con
diarrea o SUH los médicos evalúan el consumo previo
de alimentos de alto riesgo, la concurrencia a centros
de salud y la exposición a otros casos de diarrea (posibles portadores de STEC)61. Como consecuencia del
estrecho contacto hombre-animal (perro/gato) en
centros urbanos, se consideró una alta probabilidad
de transmisión de microorganismos entre dichos hospederos. Se ha informado que la alimentación de las
mascotas en Argentina puede incluir la carne cruda
en forma permanente o esporádica. Existen muchas
referencias respecto a la contaminación de carnes con
cepas STEC y los relevamientos locales determinaron
un alto riesgo de contaminación por STEC en alimentos como la carne molida. Dado el impacto del SUH en
la población, el conocimiento de portadores reservorios, fuentes de infección y su difusión, adquiere elevada
importancia al ejecutar políticas de salud destinadas al control de esta enfermedad34.
El concepto “Una Salud” propone un abordaje amplio para minimizar el impacto de las enfermedades en la salud humana y animal, que ocasionan grandes pérdidas económicas y que están
vinculadas a los ecosistemas en los cuales coexisten. La propagación de enfermedades transfronterizas, la emergencia de patógenos y las crecientes
alteraciones en el medio ambiente, requieren la
implementación de estrategias integradas para su
conocimiento, prevención y control, en particular
al considerar el origen animal del 75% de las enfermedades emergentes.
Al día de hoy, quedan interrogantes por
resolver. La región Sur de Argentina, y en particular TDF, mantiene tasas de incidencia elevadas,
sin embargo, el grado de contaminación de las
posibles fuentes de infección es menor a la región
continental. Dada la plasticidad del genoma de E.
coli es preciso establecer si los aislamientos provenientes de TDF corresponden a linajes virulentos, lo cual podría ser la variable explicativa de la
alta casuística de DAS y SUH en la región.
AGRADECIMIENTOS
El trabajo contó con financiamiento parcial del Ministerio de Salud de la Nación. Becas Abraam Sonis. NRU 2765. Ministerio de Ciencia, Tecnología e Innovación PICT-2017-3360 y UBACyT 20020190100320BA.
1. Acuña, P.; Rojas, N.; Florentin, M.; Rodriguez, F.
Estandarización de una técnica de PCR múltiple para la
detección de los serogrupos O157, O104 y “big six” de
Escherichia coli productora de la toxina Shiga (STEC).
Memorias del Instituto de Investigaciones en Ciencias de
la Salud, 2019; 17(2): 71-6.
2. Bentancor, A. Epidemiological role of pets in urban transmission cycle of STEC. Medicina 2006; 66 Suppl 3:37-41.
3. Bentancor, A. Evaluación de posibles reservorios animales,
domésticos o sinantrópicos, implicados en brotes de SUH
producidos en centros urbanos. Jornadas SACyT, Ministerio
de Salud de la Nación, 25 de noviembre, 2008. Buenos Aires.
4. Bentancor, A.; Agostini, A.; Rumi, M.V.; Degregorio, O.J.
Factores de riesgo de infección por cepas de Escherichia coli
shigatoxigénicas en gatos y perros. InVet 2008; 10(1)1-13.
5. Bentancor, A.; Calviño, M.; Manfredi, F.; et al. Isolation of
Shiga toxin-producing Escherichia coli from household
pets and Rattus rattus related to outbreaks of hemolytic
uremic syndrome. 7th International Symposium on Shiga
Toxin (Verocytotoxin) Producing Escherichia coli Infections, 10-13 de mayo, 2009. Buenos Aires.
6. Bentancor, A.; Natale, D.; Miraglia, M.; Marcos, E.;
Degregorio O. Geographic information systems to
identify areas at risk of sporadic hemolytic uremic
syndrome in Buenos Aires City, Argentina. Zoonoses
and Public Health, 2012; 59 (Suppl.1), 23.
7. Bentancor, A.; Rumi, M.V.; Gentilini, M.V.; et al. Shiga
toxin-producing and attaching and effacing E. coli in
cats and dogs in a high Hemolytic Uremic Syndrome
incidence region in Argentina. FEMS Microbiol Lett.
2007; 267(2):251-6.
8. Beutin, L.; Geier, D.; Steinrück, H.; Zimmermann, S.;
Scheutz, F. Prevalence and some properties of verotoxin
(Shiga-like toxin)-producing Escherichia coli in seven different species of healthy domestic animals. J Clin Microbiol
1993; 31:2483-8.
9. Beutin, L. Emerging enterohaemorrhagic Escherichia coli,
causes and effects of the rise of a human pathogen. J Vet
Med B Infect Dis Vet Public Health, 2006; 53(7):299-305.
10. Beutin, L.; Fach, P. Detection of Shiga Toxin-Producing.
Escherichia coli from Nonhuman Sources and Strain
Typing. Microbiol Spectrum 2014; 2(3).
11. Blanco M.; Padola, N.L.; Krüger, A.; et al. Virulence genes
and intimin types of Shiga-toxin-producing Escherichia
coli isolated from cattle and beef products in Argentina.
Int Microbiol., 2004; 7(4):269-76.
12. Blanco Crivelli, X.; Rumi, V.; Carfagnini, J.C.; Degregorio,
O.; Bentancor, A.B. Synanthropic rodents as possible reservoirs of shigatoxigenic Escherichia coli strains. Front
Cell Infect Microbiol. 2012; 2:134.
13. Blanco Crivelli, X.; Bonino, M.P.; Von Wernich Castillo,
P.; Navarro, A.; Degregorio, O.; Bentancor, A. Detection
and Characterization of Enteropathogenic and Shiga
Toxin-Producing Escherichia coli Strains in Rattus spp.
from Buenos Aires. Front Microbiol., 2018; 9: 199.
14. Blanco Crivelli, X.; Bonino, M.P.; Sanin, M.S.; Petrina,
J.F.; Disalvo, V.N.; Massa, R.; Miliwebsky, E.; Navarro, A.;
Chinen, I.; Bentancor, A. Potential zoonotic pathovars
of diarrheagenic Escherichia coli detected in lambs for
human consumption from Tierra del Fuego, Argentina.
Microorganisms, 2021; 9,1710.
15. Bonino, M.P.; Petrina, J.; Von Wernich Castillo, P.; et
al. Analysis of reservoirs of Shiga toxin-producing
Escherichia coli in Tierra del Fuego, Argentina. 10th
International Symposium on Shiga Toxin (Verocytotoxin)
Producing Escherichia coli Infections, Mayo 6-9, 2018.
Florencia, Italia.
16. Brandt, S.M.; King, N.; Cornelius A.J.; Premaratne,
A.; Besser, T.E.; On, S.L. Molecular risk assessment
and epidemiological typing of Shiga toxin-producing
Escherichia coli by using a novel PCR binary typing
system. Appl Environ Microbiol. 2011; 77(7):2458-70.
17. Broglio, A.; Bentancor, A. The paradigm of ground meat
as source of STEC in high risk area of HUS from Argentina. J Bacteriol Mycol Open Access. 2019; 7(5):102‒5.
18. Brusa, V.; Aliverti, V.; Aliverti, F.; et al. Shiga toxin-producing
Escherichia coli in beef retail markets from Argentina.
Frontiers in Cellular and Infection Microbiology, 2013; 2(171): 1-6.
19. Cabal, A.; Vicente, J.; Alvarez, J.; et al. Human influence
and biotic homogenization drive the distribution of
Escherichia coli virulence genes in natural habitats.
Microbiology Open 2017; 6(3): e00445.
20. Calviño, M.F.; Ameal, A.; Bentancor A. Grado de contaminación por STEC en carne molida a la vista. En: La
investigación en la Universidad Latinoamericana a 90
años de la Reforma de Córdoba, Ed. Universidad de la República. ISBN del libro: 978-9974-0-0528-0. Uruguay,
2008; 2920-8
21. Carbonari, C.; Deza, N.; Flores, M.; Gasparini, A.; Manfredi,
E; Rivas, M. First isolation of enteroaggregative Escherichia
coli O104:H4 from a diarrhea case in Argentina. Rev Argent
Microbiol. 2014; 46:302-6.
22. Chinen, I.; Tanaro, J.; Miliwebsky, E.; et al. Isolation
and Characterization of Escherichia coli O157:H7 from
Retail Meats in Argentina. Journal of Food Protection
2001; 64:9; 1345-51.
23. Cicuta, M.; Deza, N.; Roibón, W.; Arzú, O.; Barceló, M.
Shiga toxin-producing Escherichia coli in ground beef
and sausages from Corrientes, Argentina. Revista Veterinaria 2009; 20(1):11-14.
24. Cízek, A.; Alexa, P. Literák, I.; Hamrík, J.; Novák, P.;
Smola, J. Shiga toxin-producing Escherichia coli O157
in feedlot cattle and Norwegian rats from a large-scale
farm. J Lett App Microbiol, 1999; 28, 435-9.
25. Cobbold, R.N.; Rice, D.H.; Szymanski, M.; Call, D.R.; Hancock, D.D. Comparison of shiga-toxigenic Escherichia
coli prevalences among dairy, feedlot, and cow-calf
herds in Washington State. Applied And Environmental
Microbiology, 2004; 70 (7):4375-78.
26. Código Alimentario Argentino. Ministerio de Agroindustria, 2017. En: https://www.argentina.gob.ar/anmat/codigoalimentario.
27. Crump, J.A.; Sulka, A.C.; Langer, A.J.; et al. An outbreak
of Escherichia coli O157:H7 infections among visitors to
a dairy farm. N Engl J Med, 2002; 22;347(8):555-60.
28. Cundon, C. Estudio clonal y filogenético de aislamientos
de Escherichia coli productores de toxina Shiga pertenecientes al serogrupo O174 de circulación regional.
Tesis doctoral Universidad de Buenos Aires, Facultad
de Ciencias Veterinarias.
29. Cundon, C.; Carbonari, C.C.; Zolezzi, G.; Rivas, M.; Bentancor, A. Putative virulence factors and clonal relationship
of O174 Shiga toxin-producing Escherichia coli isolated
from human, food and animal sources. Vet Microbiol.
2018; 215:29-34.
30. de Boer, R.F.; Ferdous, M.; Ott, A.; et al. Assesing the
Public Health Risk of Shiga Toxin-Producing Escherichia
coli by Use of a Rapid Diagnostic Screening Algorithm. J
Clin Microbiol, 2015; 53:1588-98.
31. Donnenberg, M.S. E. coli. Genomics, Evolution and
Pathogenesis. 2002. ISBN 9780122207518. Academic
Press. 1st edition.417p
32. Etcheverría, A.; Padola, N.L. Shiga toxin-producing
Escherichia coli Factors involved in virulence and cattle
colonization. Virulence, 2013; 4 (5): 366–72.
33. Etcheverría, A.; Padola, N.L.; Sanz, M.; et al. Occurrence
of Shiga toxin-producing E. coli (STEC) on carcasses
and retail beef cuts in the marketing chain of beef in
Argentina. Meat Science 2010; 86: 418-21.
34. Exeni, R.A. Síndrome urémico hemolítico. Medicina,
1996; 56(2).
35. Farfán García, A.E.; Arias Guerrero, M.Y.; Zhang, C.; et
al. Patotipos diarreagénicos emergentes de Escherichia
coli en Colombia. Innovaciencia, 2016; 3: 1-11.
36. Fernández, D.; Krüger, A.; Polifroni, R.; et al. Characterization of Shiga toxin-producing Escherichia
coli O130:H11 and O178:H19 isolated from dairy
cows. Frontiers in Cellular and Infection Microbiology, 2013; 3:9.
37. FSIS/USDA MLG 5.06. Detection, Isolation and Identification of Escherichia coli O157:H7 from Meat Products. En: http://www.fsis.usda.gov/wps/wcm/connect/d39555c5-32b9-4c92-9101-66d8922482d8/
MLG_5_06.pdf?MOD=AJPERES Consultado el 21 de
abril de 2014
38. FSIS/USDA MLG 5B.05. Detection and Isolation of
non-O157 Shiga-toxin Producing Escherichia coli Strains
(STEC) from Meat Products. http://www.fsis.usda.
gov/wps/wcm/connect/7ffc02b5-3d33-4a79-b50c-8
1f208893204/MLG-5B.pdf?MOD=AJPERES Consultado
el 21 de abril de 2014.
39. Fukushima, H.; Seki. R . High numbers of Shiga
toxin-producing Escherichia coli found in bovine
faeces collected at slaughter in Japan. FEMS Microbiol
Lett. 2004; 238(1): 189-97.
40. Gianantonio, C.A.; Vitacco, M.; Mendilaharzu, F.;
Gallo, G.E.; Sojo, E.T. The Hemolytic-Uremic Syndrome. Nephron, 1973; 11:174–92.
41. Gioffré, A.; Meichtri, L.; Miliwebsky, E.; et al. Detection of
Shiga toxin-producing Escherichia coli by PCR in cattle in
Argentina. Evaluation of two procedures. Vet Microbiol.,
2002; 87(4):301-13.
42. Gobierno de la Provincia de Tierra del Fuego. DEIS
IT01/2013. Resumen ejecutivo Vigilancia epidemiológica de las diarreas en TDF
43. Gomez, D.; Miliwebsky, E.; Fernandez Pascua, C.; et al.
Aislamiento y caracterización de Escherichia coli productora de verotoxina de hamburguesas congeladas
y quesos blandos. Revista Argentina de Microbiología
2002; 34: 66-71.
44. Gomez Duarte, O. Enfermedad diarreica aguda por
Escherichia coli enteropatógenas en Colombia. Rev.
Chilena Infectol., 2014; 31:577-86.
45. Gyles C.L. Shiga toxin-producing Escherichia coli: An
overview. J Anim Sci 2007; 85, 45-62.
46. Hussein H.S.; Sakuma, T. Prevalence of shiga toxin-producing
Escherichia coli in dairy cattle and their products. J Dairy
Sci, 2005; 88(2):450-65.
47. Iriarte, I. (2007) Comercialización de ganados y carnes.
Cámara Argentina de Consignatarios de Ganado. Buenos
Aires, Argentina.
48. Irino, K.; Kato, M.A.M.; Vaz, T.M.I.; et al. Serotypes and
virulence markers of Shiga toxin-producing Escherichia
coli (STEC) isolated from dairy cattle in São Paulo State,
Brazil. Vet Microbiol., 2005; 5;105(1):29-36.
49. Jure, M.; Condori, S.; Leotta, G.; et al. Detección, aislamiento
y caracterización de Escherichia coli productor de toxina
Shiga a partir de carne molida fresca proveniente de
carnicerías de Concepción, provincia de Tucumán.
Revista Argentina de Microbiología, 2010; 42: 284-7.
50. Kaper, J.B.; O’Brien, A.D. Overview and Historical
Perspectives. Microbiol Spectr, 2014;2(6):10.
51. Karmali, M.A. Infection by verocytotoxin-producing
Escherichia coli. Clin Microbiol Rev, 1989; 2(1):15-38.
52. Karmali, M.A.; Gannon, V.; Sargeant, J.M. Verocytotoxin
-producing Escherichia coli (VTEC). Review. Vet Microbiol.
2010; 140:360-70.
53. Karmali, M.A.; Mascarenhas, M.; Shen, S.; et al. Association
of genomic O island 122 of Escherichia coli EDL 933 with
verocytotoxin-producing Escherichia coli seropathotypes
that are linked to epidemic and/or serious disease. J Clin
Microbiol, 2003; 41(11):4930-40.
54. Konowalchuk, J.; Speirs, J.I.; Stavric, S. Vero response
to a cytotoxin of Escherichia coli. Infect Immun, 1977;
18(3):775-9.
55. Kudva, I.T.; Hatfield, P.G.; Hovde, C.J. Escherichia coli
O157:H7 in microbial flora of sheep. J Clin Microbiol,
1996; 34(2):431-3.
56. Leotta, G.; Deza, N.; Origlia, J.; et al. Detection and
characterization of Shiga toxin-producing E. coli in
captive non-domestic mammals. Vet Microbiol, 2006;
118:151-7.
57. Manfredi, F.; Aguirre, M.; Bentancor, A. Georreferencia
de casos de Síndrome Urémico Hemolítico y su relación con los cursos de agua subterráneos. Evaluación
ambiental de las rutas de transmisión de Escherichia
coli Shigatoxigénica. XVII Jornadas de Jóvenes Investigadores. Asociación de Universidades Grupo Montevideo
(AUGM), 2009. Entre Ríos, Argentina.
58. Manning, S.D.; Motiwala, A.S.; Sprigman, A.C.; et al.
Variation in virulence among clades of Escherichia coli
O157:H7 associated with disease outbreaks. Proceedings
of National Academy of Sciences of the United States of
America, 2008; 105: 4868-73.
59. Marcos, E. El Concepto Una salud Como Integrador de
la Interfase Humano-Animal-Ambiental, Frente a las
Enfermedades Emergentes, Reemergentes y Transfronterizas. Epidemiologia y Salud, 2013; 1(3):16-20.
60. Marzocca, M.; Marucci, P.; Sica, M.; Alvarez, E. Detección
de Escherichia coli O157:H7 en carne picada fresca y hamburguesas congeladas. Revista Argentina de Microbiología,
2006; 38: 38-40.
61. Mead, P.S.; Griffin, P.M. Escherichia coli O157:H7. Lancet,
1998; 352(9135):1207-12.
62. Meichtri, L.; Miliwebsky, E.; Gioffré, A.; et al. Shiga
toxin-producing Escherichia coli in healthy young
beef steers from Argentina: prevalence and virulence
properties. Int. J. Food Microbiol., 2004; 96:189-98.
63. Mercado, E.C.; Gioffré, A.; Rodríguez, S.M.; et al. Non-O157
Shiga Toxin-Producing Escherichia coli isolated from
diarrhoeic calves in Argentina. J Vet Med B Infect Dis
Vet Public Health, 2004; 51(2):82-8.
64. Miccio, L.; Rumi, M.; Llorente, P.; Bentancor, A. Contaminación de carne molida con cepas de Escherichia coli
shigatoxigénico (STEC) provenientes de comercios
minorista de San Martín, Buenos Aires, categorizados
según nivel socioeconómico. INVET, 2011; 13 (1): 37-44.
65. Ministerio de Agroindustria Argentina. Presidencia de
la Nación. Modelos Regionales de Producción Ovina.
Aspectos metodológicos. 2017.
66. Ministerio de Salud Argentina. Boletín Integrado de
Vigilancia 344, SE 03, 2017. En: https://www.msal.gob.
ar/images/stories/boletines/Boletin-Integrado-De-Vigilancia-N344-SE3.pdf. Consultado 18 mayo 2020.
67. Ministerio de Salud Argentina. Boletín integrado
de Vigilancia 439, SE 06, 2019. En: https://bancos.
salud.gob.ar/recurso/boletin-integrado-de-vigilancia-n439-se6-15022019. Consultado 18 mayo 2020.
68. Ministerio de Salud Argentina. Boletín Integrado de Vigilancia 463, SE 34, 2019. En: https://www.argentina.
gob.ar/sites/default/files/biv_463_cuatrisemanal.pdf.
Consultado 18 mayo 2020.
69. Ministerio de Salud Argentina. Informe Estudio Multicéntrico, NRU 2765.
70. Montero, D.A.; Velasco, J.; Del Canto, F.; et al. Locus of
Adhesion and Autoaggregation (LAA), a pathogenicity
island present in emerging Shiga toxin-producing
Escherichia coli strains. Nature, 2017; 7: 1-13.
71. Naseer, U.; Løbersli, I.; Hindrum, M.; Bruvik, T.;
Brandal, L.T. Virulence factors of Shiga toxin-producing
Escherichia coli and the risk of developing haemolytic
uraemic syndrome in Norway, 1992–2013. Eur J Clin
Microbiol Infect Dis., 2017; 36 :1613–20.
72. Nielsen, E.M.; Skov, M.N.; Madsen, J.J. ; Lodal, J.; Jespersen,
J.B. ; Baggesen; D.L. Verocytotoxin-producing Escherichia
coli in wild birds and rodents in close proximity to
farms. Appl Environ Microbiol, 2004; 70(11):6944-7.
73. Nyholm, O.; Halkilahti, J.; Wiklund, G.; et al. Comparative
Genomics and Characterization of Hybrid Shigatoxigenic
and Enterotoxigenic Escherichia coli (STEC/ETEC)
Strains. PLoS One, 2015; 27;10(8):e0135936.
74. Oteiza, J.; Chinen, I.; Miliwebsky, E.; Rivas, M. Isolation
and characterization of Shiga toxin-producing
Escherichia coli from precooked sausages (morcillas).
Food Microbiology, 2006; 23: 283-288.
75. Parma, A.E.; Sanz, M.E.; Blanco, J.E.; et al. Virulence
genotypes and serotypes of verotoxigenic Escherichia coli
isolated from cattle and foods in Argentina. Importance
in public health. Eur J Epidemiol, 2000; 16(8):757-62.
76. Paton, A.W.; Paton, J.C. Detection and characterization of
Shiga toxigenic E. coli by using Múltiple PCR assays for
stx1, stx2, eaeA, Enterohemorrhagic E. coli hlyA, rfbO11,
and rfbO157. J. Clin Microbiol., 1998; 36(2): 598-602.
77. Pianciola, L.; Chinen, I.; Mazzeo, M.; et al. Genotypic
characterization of Escherichia coli O157:H7 strains
that cause diarrhea and hemolytic uremic syndrome in
Neuquén, Argentina. Int J Med Microbiol, 2014; 304(3-
4):499-504.
78. Pirajan, C.; Cundon, C.; Galigniana, F.; Rumi, V.; Bentancor,
A. Prevalencia de E. coli Shigatoxigenica (STEC)
en sistemas de feedlot alimentados con diferentes
esquemas nutricionales. 7º Jornadas Internacionales De
Veterinaria Práctica, 2011. Mar del Plata, Argentina.
79. Rivas, M. Avances en el Conocimiento de la Epidemiología de STEC. Experiencia en Frigoríficos de Argentina.
Primer Simposio Life Technologies en Seguridad de Alimentos, 8 de mayo, 2013. Buenos Aires.
80. Rivas, M. Epidemiología del Síndrome Urémico Hemolítico en Argentina. Situación actual e innovaciones
diagnósticas. Servicio Fisiopatogenia INEI – ANLIS
“Dr. Carlos G. Malbrán”. Jornada de Síndrome Urémico
Hemolítico, 2016. Buenos Aires, Argentina. En: http://
www.sap.org.ar/uploads/archivos/files_dra-rivas-epidemiologia-del-sindrome-uremico-hemolitico-en-argentina-situacion-actual-e-innovaciones-diagnosticas_1494446234.pdf Consultado 6 de diciembre 2017.
81. Rivas, M.; Chinen, I.; Miliwebsky, E.; Masana, M. Risk
Factors for Shiga Toxin-Producing Escherichia coli-Associated Human Diseases. Microbiology Spectrum,
2014; 2, (5).
82. Rivas, M.; Padola, N.L.; Lucchesi, P.M.A.; Masana, M. Diarrheagenic Escherichia coli in Argentina. En Torres, A.G.
(Ed) Pathogenic Escherichia coli in Latin America. Bentham Science Publishers, U.S.A, 2010: 142-161.
83. Rivas, M.; Voyer, L.; Tous, M.; et al. Verocytotoxin-producing Escherichia coli infection in family members of
children with hemolytic uremic síndrome. Medicina,
1996; 56(2):119–125.
84. Rivero, M.A.; Passucci, J.A.; Rodríguez, E.M.; Parma,
A.E. Seasonal variation of HUS occurrence and VTEC infection in children with acute diarrhoea from Argentina. European Journal of Clinical Microbiology & Infectious
Diseases, 2012; 31 (6): 1131–35.
85. Riley, L.W.; Remis, R.S.; Helgerson, S.D.; et al. Hemorrhagic
colitis associated with a rare Escherichia coli serotype. N
Engl J Med, 1983; 308(12):681-5.
86. Roldan, M.; Chinen, I.; Otero, J.; et al. Aislamiento, caracterización y subtipificación de cepas de Escherichia coli
O157:H7 a partir de productos cárnicos y leche. Revista
Argentina de Microbiología, 2007; 39:113-19.
87. Rumi, M.V.; Blanco Crivelli, X.; Calviño, M.; et al. Escherichia
coli Shigatoxigénica en animales relacionados con casos de
diarreas sanguinolentas o síndrome urémico hemolítico
y prevalencia en roedores de la Ciudad de Buenos Aires.
Revista Argentina de Salud Pública, 2012; Vol. 3 Núm. 11.
88. Rumi, M.V.; Calviño, M.F.; Regalia, A; Bentancor, A.
Isolation of Shiga toxin-producing Escherichia coli from
household pets related to cases of hemolytic uremic syndrome and bloody diarrhea. Zoonoses and Public
Health, 2012; 59 (Suppl.1), 19–90.
89. Rumi, M.V.; Gentilini, M.V.; Calviño, F.; et al. Contaminación de carne molida con cepas STEC según nivel
socioeconómico de expendio. Revista Argentina de Microbiología, 2007; 39(1):135.
90. Rumi, M.V.; Irino, K.; Deza, N.; Huguet, M.J.; Bentancor,
A.B. First isolation in Argentina of a highly virulent
Shiga toxin-producing Escherichia coli O145:NM from
a domestic cat. J Infect Dev Ctries, 2012; 6(4):358-63.
91. Scheutz, F.; Teel, L.D.; Beutin, L.; et al. Multicenter
evaluation of a sequence-based protocol for subtyping
Shiga toxins and standardizing Stx nomenclature.
Journal of Clinical Microbiology, 2012; 50:2951-63.
92. Singh, P.; Sha, Q.; Lacher, D.W.; et al. Characterization
of enteropathogenic and Shiga toxin-producing
Escherichia coli in cattle and deer in a shared
agroecosystem. Front Cell Infect Microbiol, 2015; 5:29.
93. Spizzirri, F.D.; Rahman, R.C.; Bibiloni, N.; Ruscasso, J.D.;
Amoreo, O.R. Childhood hemolytic uremic syndrome
in Argentina: long-term follow-up and prognostic
features. Pediatr Nephrol, 1997; 11(2):156-60.
94. Tanaro, J.D.; Leotta, G.; Lound, L.H.; et al. Escherichia
coli O157 in bovine feces and surface water streams in a
beef cattle farm of Argentina. Foodborne Pathogens and
Disease, 2010; 7 (4): 475-7.
95. Tarr, P.I. Escherichia coli O157:H7: clinical, diagnostic,
and epidemiological aspects of human infection. Clin
Infect Dis, 1995; 20(1):1-8.
96. Tasso, L.; Iachini, R.; Bentancor, A. Vigilancia de Escherichia coli Shigatoxigénica en murciélagos. Congreso
SADEBAC 2006. Octubre 31-Noviembre 1, 2006. Buenos
Aires: Asociación Argentina de Microbiología.
97. Torres, A.G. Pathogenic Escherichia coli in Latin
America. 625 pp. Editor: Alfredo G. Torres, PhD. Ed.
Bentham Science Publisher e-book. USA, 2010. ISBN
978-1-60805-571-5.
98. Torres, A.G. Escherichia coli in the Americas. 384 pp.
Editor: Alfredo G. Torres, PhD. Ed. Springer. USA, 2016.
ISBN 978-3-319-45092-6.
99. Vaz, TMI.; Irino, K.; Kato, MAM.; et al. Virulence
properties and characteristics of Shiga toxin-producing
Escherichia coli in São Paulo, Brazil, from 1976 through
1999. J Clin Microbiol, 2004; 42(2):903-5.
100. World Health Organization. Global priority list of
antibiotic-resistant bacteria to guide research,
discovery, and development of new antibiotics, 2017.
En: http://www.who.int/medicines/publications/
WHO-PPL-Short_Summary_25Feb-ET_NM_WHO.pdf
consultado 7 de noviembre 2019.