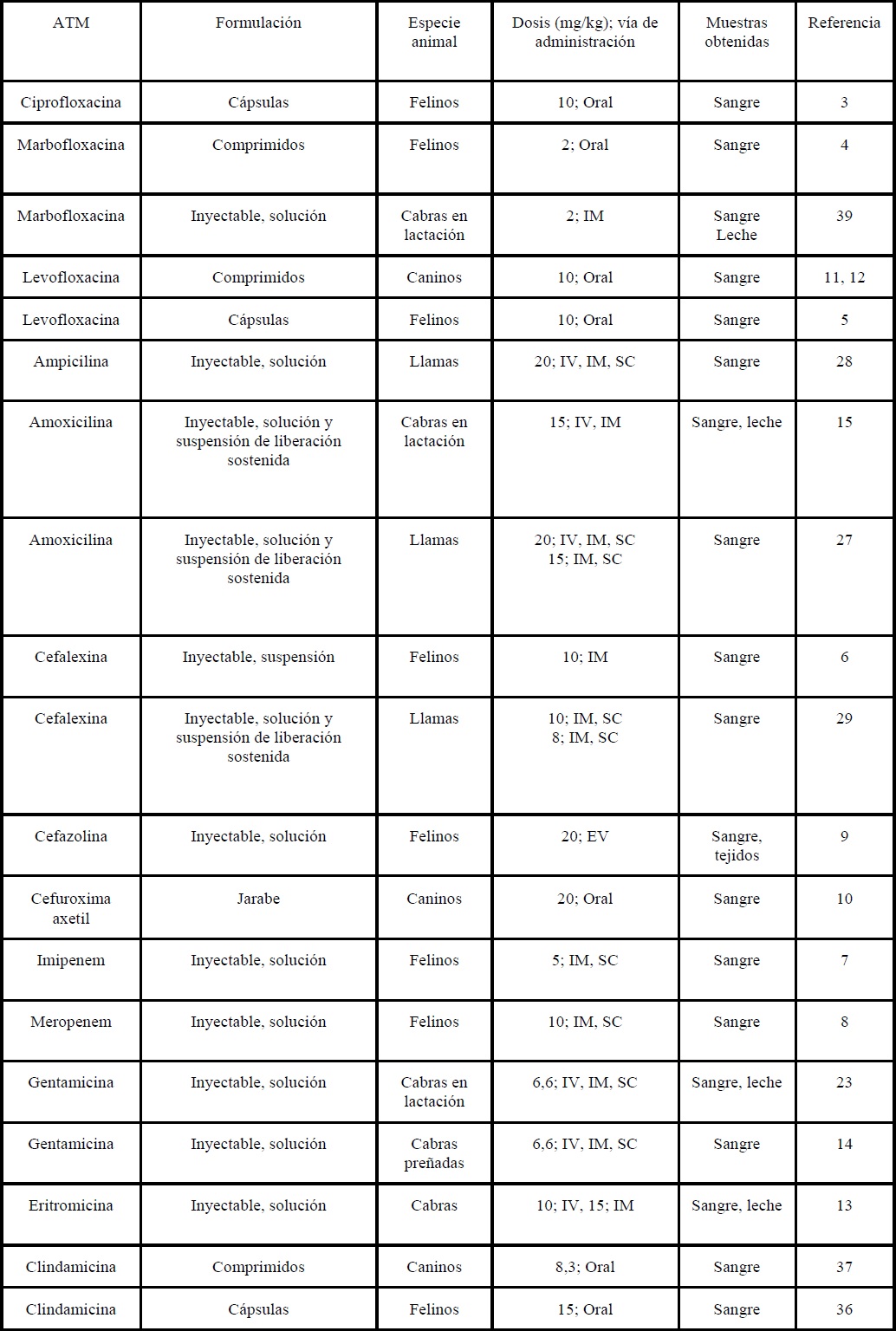
Tabla 1.ATM, formulación, especie animal, dosis y vía de administración utilizadas, muestras obtenidas y fuente bibliográfica de los datos.
REVISIÓN BIBLIOGRÁFICA
Aplicación de los parámetros farmacocinéticos/farmacodinámicos (PK/PD) en la optimización terapéutica de los antimicrobianos.
Ambros, LA1,2; Kreil, VE1; Montoya, L1; Monfrinotti, A1; Passini, SM1; Lupi, MP1; Doxandabarat, XD1; Esmoris, S1suárez Belzoni, F1Paes Rodríguez, JD1Vera, V1Almoño, B1Lorenzini, PM1Aramayona, SI1Albarellos, GA1.
1
Universidad de Buenos Aires, Facultad de Ciencias Veterinarias, Cátedra de Farmacología.
2
CONICET-Universidad de Buenos
Aires. Instituto de Investigaciones en Producción Animal (INPA). Buenos Aires. Argentina.
Recibido:27/08/2021
Aceptado:27/10/2021
Correspondencia e-mail:Luis Ambros ambros@fvet.uba.ar
Resumen
El uso intensivo de antimicrobianos (ATM), tanto en medicina humana como veterinaria, ha llevado a un incremento de los niveles de resistencia de las bacterias a los mismos. Esta problemática se agrava teniendo en cuenta que los ATM son un recurso limitado y en los últimos años no se han sintetizado nuevos agentes. Sin embargo, estos fármacos siguen siendo las herramientas imprescindibles para controlar o eliminar infecciones. Por esta razón, para preservar su eficacia deben emplearse estrategias que optimicen su empleo basadas en el conocimiento acabado del agente infeccioso causal, su susceptibilidad a ATM y en la aplicación del conocimiento farmacológico en las distintas especies animales. Los índices que relacionan propiedades farmacocinéticas y farmacodinámicas, llamados índices PK/ PD, han demostrado ser efectivos tanto para lograr eficacia como para disminuir la aparición de resistencia bacteriana. Se estudió el comportamiento farmacocinético de diversos ATM (betalactámicos, fluoroquinolonas, aminoglucósidos, macrólidos, lincosamidas, etc.) en distintos animales domésticos (perros, gatos, cabras, llamas), administrados por distintas vías (IV, IM, SC, oral, intramamaria) y empleando diferentes formulaciones (inyectables solubles y de liberación sostenida, comprimidos, etc.). Para esto se evaluaron las concentraciones de los mismos en la sangre, leche y en diversos tejidos (cuando estos fueron accesibles). Se construyeron en cada caso las curvas de disposición y se determinaron los parámetros farmacocinéticos correspondientes. Con la información obtenida se calcularon los parámetros PK/PD y se elaboraron recomendaciones para optimizar su empleo terapéutico en las especies estudiadas.
Palabras clave:antibióticos, farmacocinética, farmacodinamia, animales, terapéutica
Application of pharmacokinetics/pharmacodynamics parameters (PK/PD) on antimicrobials therapeutic optimization.
Summary
Intensive use of antimicrobials (ATM), both in human and veterinary medicine, have produced an increase of resistance levels in bacteria strains. This scenario is worse when considering that ATM are a scarce resource and that there is no new ATM in the market. However, ATM still are essential tools for infection control or eradication. So, in order to preserve ATM efficacy, therapeutic strategies involving knowledge of bacteria susceptibility and ATM pharmacological data from different animal species are mandatory. Relationships between pharmacokinetic and pharmacodynamic ATM features, named PK/PD predictors, are effective for attain efficacy in infection treatment and, also to minimize bacterial resistance emergence. We have studied the pharmacokinetic behaviour of many ATM agents (betalactams, fluoroquinolones, aminoglycosides, macrolides, lincosamides, etc.) in different domestic animal species (dogs, cats, goats, llamas) administered through different routes (IV, IM, SC, oral, intramammary) and using different formulations (soluble or sustained release injectable forms, tablets). Plasma, milk and tissue ATM concentrations were evaluated. Disposition curves were done and pharmacokinetic parameters were calculated. PK/PD predictors were estimated and ATM therapeutic recommendations for each animal species were suggested.
Key words: antibiotics, pharmacokinetic, pharmacodynamic, animals, therapeutic
INTRODUCCIÓN
En la actualidad, uno de los principales problemas de importante implicancia
tanto en medicina humana como veterinaria
es el incremento en los niveles de resistencia
de las bacterias hacia los distintos grupos de
antimicrobianos. Dentro de sus causas, una
de las más importantes es el uso intensivo y
no racional que se hace de estas drogas. Es
imprescindible tener en cuenta que, además
del creciente fracaso terapéutico en su uso,
la síntesis de nuevas moléculas es un recurso
limitado y en los últimos años casi no han
aparecido en el mercado nuevas moléculas.
Por esta razón, para preservar su eficacia
deben emplearse estrategias que optimicen su empleo basadas en el conocimiento
acabado del agente infeccioso causal y su
susceptibilidad al ATM (mediante pruebas de
aislamiento y de sensibilidad –antibiograma
o CIM-) y en la aplicación del conocimiento
farmacológico de estos fármacos en las distintas especies animales (estudios farmacocinéticos)1,16,21,32,34,35.
Los índices que relacionan propiedades
farmacocinéticas, como ser el área bajo la curva
de concentración plasmática en función del
tiempo o curva de disposición (ABC o AUC), la
concentración plasmática máxima alcanzada
luego de una administración extravascular
(Cmax), o el tiempo por el cual las concentraciones
plasmáticas del antimicrobiano permanecen
por valores superiores a la CIM de la bacteria
(T>CIM) y farmacodinámicas (CIM), llamados
predictores de eficacia o índices farmacocinética
/ farmacodinamia (PK/PD), si bien han
demostrado ser efectivos para lograr la cura
clínica no siempre conducen a la disminución de
aparición de resistencia bacteriana25.
Se acepta que para fluoroquinolonas
el indicador Cmax/CIM debe ser mayor
a 8-10, mientras que el indicador ABC/
CIM debe ser superior a 125 cuando se
consideran infecciones por microorganismos
gramnegativos y superior a 30-50 en el
caso de que el agente etiológico sea un
grampositivo2, 26, 30.
En el caso de los betalactámicos
el indicador empleado es T>CIM, el valor
esperado dependerá del tipo de betalactámico
que se considere, siendo para penicilinas
mayor al 50 % del intervalo posológico, para
cefalosporinas se recomienda un valor mayor
al 60-80 % y para los carbapenemos, mayor al
30-40 % del intervalo31, 40, 41, 42.
Para predecir el éxito terapéutico de
los aminoglucósidos se emplea como indicador
Cmax/CIM que debe ser superior a 8-1017, 18, 22.
Los grupos de macrólidos y
lincosamidas utilizan como indicador de
eficacia el T>CIM cuyo valor dependerá del
tipo de ATM que se considere, el que depende
principalmente de su volumen de distribución.
Se recomienda que el T>CIM sea superior al
40-60 % del intervalo posológico43.
Con el objetivo de calcular los predictores
PK/PD de ATM, en la Cátedra de Farmacología
de la Facultad de Ciencias Veterinarias de la
Universidad de Buenos Aires, se han llevado
a cabo diferentes estudios para determinar el
comportamiento farmacocinético de diversos
agentes ATM (betalactámicos, fluoroquinolonas,
aminoglucósidos, macrólidos, lincosamidas) en
distintos animales domésticos (perros, gatos,
cabras, llamas), administrados por distintas
vías (iv, im, sc, oral, intramamaria) y empleando
diferentes formulaciones (inyectables solubles y
de liberación sostenida, comprimidos, etc.).
La importancia de estudiar la
farmacocinética de cada antimicrobiano
en cada especie en particular se pone de
manifiesto principalmente en aquellos casos
en los que las modificaciones encontradas
conducen a la necesidad de modificar los
regímenes posológicos. A lo largo de los años,
nuestros resultados han permitido el diseño de
esquemas adecuados para diferentes especies
animales en diferentes situaciones clínicas
y bajo determinadas situaciones fisiológicas
o patológicas. En este trabajo se resumirá y
discutirá algunos de los aportes significativos
surgidos de las diferentes experiencias.
ATM, ESPECIE ANIMAL Y FORMULACIONES EMPLEADAS
Se evaluaron ATM pertenecientes a
diferentes grupos químicos, fluoroquinolonas
(ciprofloxacina en caninos y felinos; marbofloxacina
en caprinos y felinos; levofloxacina en caninos y
felinos), betalactámicos penicilinas (ampicilina
en llamas y amoxicilina en cabras y llamas),
betalactámicos cefalosporinas (cefalexina en
felinos y llamas; cefuroxima en caninos; cefazolina
en felinos), betalactámicos carbapenemos
(imipenem y meropenem en felinos), lincosamidas
(clindamicina en caninos y felinos), macrólidos
(eritromicina en cabras), aminoglucósidos
(gentamicina en cabras) (Tabla 1).
Se administraron según las vías de
administración recomendadas por los laboratorios
productores y se tomaron muestras seriadas
(de sangre, tejido y leche según correspondiera
para cada ensayo) (Tabla 1). Se evaluaron las
concentraciones de los ATM en las respectivas
muestras, se construyeron en cada caso las curvas
de disposición (modificación de la concentración
del ATM en función del tiempo) y se determinaron
los parámetros farmacocinéticos correspondientes.
RESULTADOS
Con la información obtenida y, mediante la aplicación de la CIM de microorganismos patógenos incluidos en el espectro del ATM evaluado, se calcularon los parámetros PK/PD (Tabla 2).
DISCUSIÓN Y CONCLUSIONES
Fluoroquinolonas
Si bien el resultado obtenido en los
indicadores de eficacia está directamente relacionado
con el valor de CIM utilizado (que a su vez depende
de la susceptibilidad reportada para los patógenos
aislados de las distintas especies animales), se
puede observar una marcada diferencia entre los
indicadores obtenidos en cada especie.
Así cuando se estudió ciprofloxacina en
felinos se encontró que no se cumplía con los valores
esperados para los indicadores (excepto que se tratara
de microorganismos muy susceptibles, CIM ≤ 0,05
ug/ml). Estos resultados se relacionan con la pobre
biodisponibilidad oral que tiene este ATM en gatos
(F=33 %) que determina que las concentraciones
plasmáticas sean muy bajas. Por este motivo, pese a
su elevada eficacia in vitro, no puede recomendarse el
empleo de ciprofloxacina oral para el tratamiento de
infecciones sistémicas en felinos3.
Según los resultados obtenidos con
marbofloxacina, se observa que la eficacia está
en relación con el indicador y CIM utilizados en
el cálculo. En el caso de este ATM administrado a
gatos, pese a tener una excelente biodisponibilidad
oral (F=99 %), no siempre cumple con los valores
esperados para los indicadores. Cmax/CIM es ≥8-
10 cuando la CIM de los microorganismos es ≤
0,25 ug/ml. Estos resultados se deben a que las
concentraciones plasmáticas observadas en esta
especie son relativamente bajas. En cambio, si se
emplea el indicador AUC/CIM (más recomendado
en la actualidad35, 41, marbofloxacina sería eficaz
sobre microorganismos con una CIM ≤ 0,50 ug/
ml. Esta disparidad se explica por la excelente
biodisponibilidad y prolongada vida media del ATM
en gatos (t1/2=7,15 h) que resultan en elevados
valores de AUC4. Estos parámetros permiten
recomendar su empleo para el tratamiento de
infecciones producidas por microorganismos
susceptibles (CIM ≤ 0,25 ug/ml) en felinos
administrada a 2 mg/kg/24 h por vía oral4.

Tabla 1.ATM, formulación, especie animal, dosis y vía de administración utilizadas, muestras obtenidas y fuente
bibliográfica de los datos.
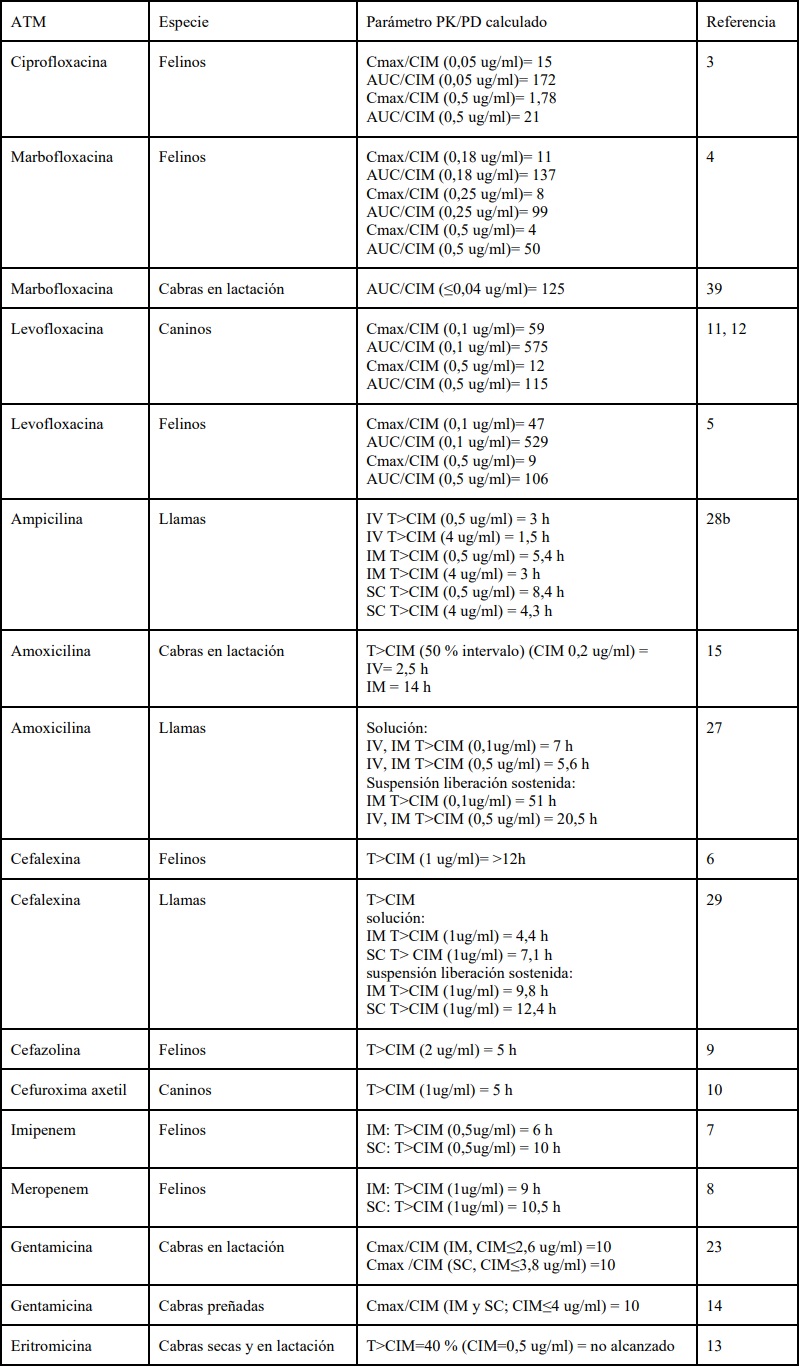
Tabla 2.ATM, especie animal, parámetro PK/PD estimado y fuente bibliográfica de los datos.
Cuando la droga fue estudiada en cabras en
lactación, si bien la vía de administración fue diferente
(IM vs PO) el comportamiento farmacocinético
mostró importantes diferencias con el de felinos,
con una vida media de entre 3 y 4 horas (según el
momento de la lactación estudiado) lo que conduce a
diferencias en relación a su uso en esta especie, siendo
recomendado a una dosis de 2 mg/kg/24 h para el
tratamiento de microorganismos con CIM ≤ 0,04 ug/
ml (como por ejemplo puede ser Escherichia coli o
Pasteurella spp.). En leche, las concentraciones fueron
detectadas únicamente luego del primer ordeñe
(12 horas post-administración de la droga). Las
concentraciones alcanzadas estuvieron influenciadas por el momento de la curva de lactación, siendo
más altas al final de la misma (cuando el volumen
producido es menor) donde se detectó una media de
0,8 ug/ml y, más bajas (0,25 ug/ml) en el pico (donde
el volumen producido es mayor)39.
De las fluoroquinolonas estudiadas en
perros y gatos, la levofloxacina es la que produce
mejores indicadores de eficacia. Esto depende de los
parámetros farmacocinéticos en ambas especies,
la biodisponibilidad oral es elevada (F=86 % en
gatos y F=109 % en caninos), las concentraciones
plasmáticas son altas (Cmax=4,7 ug/ml en gatos y
Cmax=5,94 ug/ml en perros) y tiene una prolongada
permanencia en el plasma (t1/2= 8,4h en gatos y
8,21 h en perros). Por este motivo, administrada
a 10 mg/kg/24 h por vía oral sería eficaz para el
tratamiento de infecciones sistémicas producidas
por microorganismos sensibles (CIM ≤ 0,50 ug/ml)
en ambas especies5, 11, 12.
Betalactámicos penicilinas
Los resultados obtenidos en cabras, tras
la administración de una solución de amoxicilina
sódica por vía IV o una suspensión de depósito de
amoxicilina trihidrato por vía IM, indican que en esta
especie animal, teniendo en cuenta el parámetro
de eficacia T>CIM y considerando que para las
penicilinas este valor debe ser aproximadamente
el 50 % del intervalo posológico, la administración
de una dosis de 15 mg/kg debería utilizarse frente
a bacterias muy sensibles (CIM 0,2 ug/ml) cada 5
horas por vía IV y una vez por día por vía IM. Para
el caso de bacterias con menor susceptibilidad,
la formulación de depósito, si bien permite
intervalos más espaciados que una soluble, debería
administrarse con una frecuencia de 12 a 18 horas,
dependiendo de la CIM de la bacteria15.
Cuando estudiamos las mismas
formulaciones de amoxicilina en llamas, el
comportamiento farmacocinético fue similar a los
resultados en cabras15, ya que los índices PK/PD (T >
CIM) sugieren que utilizando una dosis de 20 mg/kg
de amoxicilina sódica o de 15 mg/kg de amoxicilina
trihidrato administrada por vía IM, sería eficaz en
infecciones por microorganismos susceptibles (CIM ≤
0,50 ug/ml) administrada cada 8 o 24 h (T > CIM = 5,6
y 20,5 h), respectivamente. Sin embargo, la amoxicilina
trihidrato por vía IM (15 mg/kg) no es suficiente
para el tratamiento de infecciones producidas por
bacterias menos susceptibles (CIM > 4ug/ml), ya que
el tiempo en que las concentraciones superan la CIM
es de sólo 0,88 h, produciéndose concentraciones
subterapéuticas y pudiendo contribuir a la aparición
de resistencia bacteriana27.
Los estudios de ampicilina en llamas
demostraron que luego de su administración IV, IM
o SC (20 mg/kg), las concentraciones plasmáticas
se mantuvieron por encima de 4 µg/ml (CIM de
bacterias de susceptibilidad moderada) durante al
menos 1, 2 y 3 h, respectivamente. Si se considera
la CIM de patógenos muy susceptibles (CIM =
0,5 µg/ml), las concentraciones plasmáticas
se mantienen por encima de la misma por al
menos 2, 4 y 6 h para cada vía, respectivamente.
Según estos resultados, cuando se indique el uso
de ampicilina en llamas a dosis de 20 mg/kg,
debería administrarse cada 6 a 8 h para la vía IM,
pudiendo extenderse el intervalo posológico cada
8 o 12 h para la vía SC28.
Betalactámicos cefalosporinas
Dentro de este grupo se estudiaron algunos
representantes de cefalosporinas de primera
(cefazolina en gatos9
y cefalexina en gatos6
y llamas29)
y segunda generación (cefuroxima axetil en perros10).
En el caso de cefazolina en felinos, el
objetivo del trabajo fue determinar su perfil
plasmático y sus concentraciones en algunos
tejidos y relacionarlos con la CIM de los
microorganismos que usualmente contaminan las
heridas quirúrgicas. Por ese motivo, y considerando
un valor de CIM ≤ 2 ug/ml, el indicador T>CIM
resultó 4-5h, lo que incluye la duración de las
intervenciones quirúrgicas más frecuentes en
esta especie. Así mismo, las concentraciones en
los tejidos también fueron superiores a 2 ug/g. En
el caso de indicarse cefazolina para el tratamiento
de infecciones sistémicas, la recomendación
posológica sería administrarlo a 20 mg/kg/6 h
por vía IV (aplicando el indicador T>CIM≥ 80 %)9.
Cuando se evaluó cefalexina como una
suspensión de administración IM en felinos se
observó que, para microorganismos con una CIM ≤
1 ug/ml, el valor de T>CIM fue de 12 h, es decir que
para cumplir con T>CIM≥ 80 % la recomendación
posológica en felinos es administrar cefalexina
suspensión 10 mg/kg IM con una frecuencia
no mayor a 15 h (cada 12 h para asegurar el
cumplimiento del tratamiento)6.
En cuanto al estudio farmacocinético
de cefalexina en llamas, el objetivo fue evaluar el
comportamiento del ATM formulado con sales solubles y de liberación sostenida por diferentes vías
(IV, IM y SC), y determinar un régimen posológico
óptimo para cada preparado en esta especie.
Para microorganismos con una CIM ≤ 1 ug/
ml, las concentraciones plasmáticas de cefalexina se
mantuvieron por encima de ese valor entre el 60-
100 % si el intervalo posológico es de 6 h, mientras
que para un intervalo de 8 h es de 45-88 %. En el
caso de la formulación de depósito, los valores
fueron 81-100 % para un intervalo de dosificación
de 12 h, y 41-51 % para un intervalo posológico
de 24 h. Con estos resultados, se propone para la
formulación soluble la administración de 10 mg/
kg cada 8 h (IM) o 12 h (SC), mientras que para la
formulación de liberación sostenida, 8 mg/kg cada
12 h para la vía IM o cada 24 h para la vía SC29.
Si se observa el caso de cefuroxima
axetil administrada a caninos en dosis de 20 mg/
kg PO, el T>CIM resultó en 5 h (considerando
una CIM ≤ 1 ug/ml). Esto se relaciona con la baja
biodisponibilidad oral en esta especie (F≈50 %).10
Para que cefuroxima axetil tenga eficacia según los
parámetros PK/PD empleados para este grupo,
debería administrarse cada 6 h lo que seguramente
resultaría en una pobre adhesión al tratamiento.
Betalactámicos carbapenemos
Dentro de este grupo se evaluaron las
características farmacocinéticas de imipenem7
y
meropenem8
en felinos. Ambos ATM son de uso
reservado para infecciones resistentes a otros
ATM de primera línea25, 33.
Para estos ATM se aplicó como indicador
T>CIM≥ 40 % del intervalo posológico35, 42. En el
caso de imipenem la CIM aplicada al cálculo fue
de 0,5 ug/ml y para meropenem de 1 ug/ml. Para
las vías de administración empleadas, los valores
obtenidos para el indicador permiten recomendar
la administración de imipenem en dosis de 5
mg/kg cada 12 h por vía IM o cada 24 h por vía
SC. En el caso de meropenem, a dosis de 10 mg/
kg, la posología recomendada es cada 24 h tanto
para la administración IM como para la SC. Estas
recomendaciones están supeditadas a la gravedad de
la infección a tratar, siendo posible la administración
por vía IV para ambos ATM en los casos graves7, 8.
Aminoglucósidos
En el caso de los aminoglucósidos, la aplicación de los índices PK/PD condujo a un importante cambio en el esquema posológico de los mismos pasando de dividir la dosis diaria en tres tomas, separadas cada 8 horas, a administrarla en una sola cada 24 horas, con este régimen se logran concentraciones plasmáticas máximas más elevadas, y concentraciones en el valle más bajas lo que favorece la eficacia de estas drogas y disminuye su toxicidad17, 21, 38. Los estudios realizados con gentamicina en cabras, demostraron que, como consecuencia de la rápida y completa absorción, ni la vía de administración parenteral ni el estado fisiológico, como ser la preñez o la lactación, modifican el perfil farmacocinético de la droga. Por lo tanto, a partir de los resultados obtenidos se puede sugerir que, la administración de 6,6 mg/ kg/24 h podría ser efectiva ya sea por vía IM, SC e incluso IV para el tratamiento de microorganismos con CIM mayores a 3 - 4 ug/ml14, 23.
Macrólidos
En el caso de la eritromicina, al igual que el resto de los macrólidos, el parámetro a tener en cuenta es T>CIM≥ 40 %. El estudio realizado en cabras secas y en lactación determinó que tras la administración de 15 mg/kg por vía IM las concentraciones en plasma fueron muy bajas. Considerando una CIM de 0,5 ug/ml la Cmax apenas superó ese valor. Sin embargo, para el análisis de este tipo de drogas debe considerarse la extensa distribución por el organismo y las altas concentraciones alcanzadas a nivel tisular, comprobado por el alto valor del volumen de distribución hallado13, 19. Es por ello que la optimización del régimen posológico debería tener en cuenta los niveles tisulares de droga20. Es interesante remarcar que, al igual que en ovinos24, los niveles de eritromicina hallados en leche de cabra fueron muy superiores a los plasmáticos, evidenciándose a través de la relación AUC0-12leche/AUC0-12suero que arrojó un valor de 2,4. Así mismo, en leche, las concentraciones se mantuvieron por encima de 0,5 ug/ml por un periodo de tiempo de 8 horas13.
Lincosamidas
Clindamicina fue el representante de
este grupo de ATM evaluado en caninos (8 mg/
kg por vía oral) y en felinos (15 mg/kg por vía
oral). Se empleó como indicador T>CIM≥ 40 %
considerando microorganismos con un valor deCIM=0,12 ug/ml.
Si bien en caninos el valor del
indicador fue menor que en felinos (13,7 h
vs. 19 h), lo que podría vincularse con su
menor biodisponibilidad oral (F=62 % y
95 %, respectivamente), en ambos casos la
recomendación posológica para el tratamiento
de infecciones de localización sistémica
producidas por microorganismos susceptibles
(CIM ≤ 0,12 ug/ml) sería la administración
diaria de las dosis ensayadas por vía oral36, 37.
CONCLUSIONES
Esta recopilación de trabajos científicos pone de manifiesto la importancia de realizar estudios farmacocinéticos-farmacodinámicos en las diferentes especies con el objetivo de proponer esquemas terapéuticos adecuados a las mismas, al tipo de producción y estado fisiológico. La dosis y el esquema posológico propuestos a partir de estudios de este tipo permitirán acercarse al a un uso más racional de ATM en medicina veterinaria tendiendo a maximizar su eficacia clínica. Teniendo en cuenta, además, que la implicancia negativa del mal uso de estas drogas repercute en el desarrollo de resistencia bacteriana, estos resultados son una importante contribución para el retraso de este fenómeno.
1. Adembri, C.; Novelli, A. Pharmacokinetic and
pharmacodynamic parameters of antimicrobials.
Potential for providing dosing regimens that are less
vulnerable to resistance. Clin Pharmacokinet. 2009;
48:517-528.
2. Ahmad, I.; Huang, L.; Hao, H.; Sanders, P.; Yuan, Z.
Application of PK/PD Modeling in Veterinary Field: Dose
Optimization and Drug Resistance Prediction. BioMed Res
Int. 2016; 2016:5465678. doi: 10.1155/2016/5465678.
3.Albarellos, G.A.; Kreil, V.E.; Landoni, M.F. Pharmacokinetics
of ciprofloxacin after single intravenous and repeat
oral administration to cats. J Vet Pharmacol Ther. 2004;
27(3):155-162.
4. Albarellos, G.A.; Montoya, L.; Landoni, M.F. Pharmacokinetics
of marbofloxacin after single intravenous and repeat oral
administration to cats. Vet J. 2005; 170(2):222-229.
5. Albarellos, G.A.; Ambros, L.A.; Landoni, M.F.
Pharmacokinetics of levofloxacin after single intravenous
and repeat oral administration to cats. J Vet Pharmacol
Ther. 2005; 28(4):363-369.
6. Albarellos, G.A.; Montoya, L.; Quaine, P.C.; Landoni,
M.F. Pharmacokinetics and bioavailability of a longacting formulation of cephalexin after intramuscular
administration to cats. Res Vet Sci. 2011; 91:129-131.
7.Albarellos, G.A.; Denamiel, G.A.; Montoya, L.; Quaine, P.C.;
Lupi, M.P.; Landoni, M.F. Pharmacokinetics of imipenem
after intravenous, intramuscular and subcutaneous
administration to cats. J Feline Med Surg. 2013;15(6):483-
487.
8. Albarellos, G.; Montoya, L.; Passini, S.; Lupi, M.; Lorenzini,
P.; Landoni, M. Pharmacokinetics of meropenem
after intravenous, intramuscular and subcutaneous
administration to cats. J Feline Med Surg. 2016;
18(12):976-980. doi: 10.1177/1098612X15604655.
9. Albarellos, G.A.; Montoya, L.; Passini, S.M.; Lupi, M.P.;
Lorenzini, P.M.; Landoni, M.F. Cefazolin pharmacokinetics
in cats under surgical conditions. J Feline Med Surg. 2017;
19(10):992-997. doi: 10.1177/1098612X16666594.
10. Albarellos, G.A.; Passini, S.M.; Lupi, M.P. ; et al. Effect of
food on the pharmacokinetics of oral cefuroxime axetil
in dogs. J Vet Pharmacol Ther. 2020; 43(3):297-302. doi:
10.1111/jvp.12854.
11. Almoño, B.; Albarellos, G.; Passini, S.; Lupi, M.; Monfrinotti,
A.; Montoya, L. Farmacocinética de levofloxacina en
caninos: estudio preliminar. IX Jornadas de Jóvenes
Investigadores, 2019. Buenos Aires, Argentina.
12. Almoño, B.; Montoya, L.; Albarellos, G.; Passini, S.; Ambros,
L.; Monfrinotti, A. Biodisponibilidad de la levofloxacina
en caninos: administración oral en ayuno y con alimento.
1ras Jornadas INCLIVET Instituto de investigaciones
clínicas veterinarias, 2021. Buenos Aires, Argentina.
13. Ambros, L.; Montoya, L.; Kreil, V.; et al. Pharmacokinetics
of erythromycin in non-lactating and lactating goats after
intravenous and intramuscular administration. J Vet
Pharmacol Ther. 2007; 30:80-85.
14. Ambros, L.; Kreil, V.; Prados, A.P.; et al. Cinética
comparativa de la gentamicina en cabras preñadas
administrada por las vías intravenosa, intramuscular y
subcutánea. Rev Med Vet Bs As. 2013; 94(2):37-43.
15. Ambros, L.A.; Kreil, V.E.; Tarragona, L.; Brynkier, J.; Veksler
Hess, J. Farmacocinética de la amoxicilina en cabras en
lactación. Rev Med Vet Bs As. 2015; 96(1):16-20.
16. Asín-Prieto, E.; Rodríguez-Gascón, A.; Isla, A. Applications
of the pharmacokinetic/pharmacodynamic (PK/PD)
analysis of antimicrobial agents. Infect Chemother.
2015; 21:319-329.
17. Blaser, J.; Stone, BB.; Groner, MC.; Zinner, SH.
Comparative study with enoxacin and netilmicin in a
pharmacodynamic model to determine importance
of ratio of antibiotic peak concentration to MIC for
bactericidal activity and emergence of resistance.
Antimicrob Agents Chemother.1987; 31:1054– 60.
18. Craig, W.A. Pharmacokinetic/Pharmacodynamic
parameters: rationale for antibacterial dosing of
mice and men. Clin Infect Dis. 1998; 26:1-10.
19. Daikos, GL.; Lolans, VT.; Jackson, GG. First-exposure
adaptive resistance to aminoglycoside antibiotics in vivo
with meaning for optimal clinical use. Antimicrob Agents
Chemother. 1991; 35:117-23.
20. den Hollander, JG.; Knudsen, JD.; Mouton, JW.; et al.
Comparison of pharmacodynamics of azithromycin and
erythromycin in vitro and in vivo. Antimicrob. Agents
Chemoter. 1998; 42:377-382.
21. Drusano, G.L. Prevention of resistance: a goal for dose
selection for antimicrobial agents. Clin Infect Dis. 2003;
36 Suppl 1:42-50.
22. . Drusano, G.L. Antimicrobial pharmacodynamics: critical
interactions of “bug and drug”. Nat Rev Microbiol. 2004;
2:289-300.
23. Esmoris, S.; Vera, V.; Suárez Belzoni, F.; Kreil, V.; Ambros,
L. Perfil farmacocinético de la gentamicina en cabras en
lactación. InVet. 2020; 22(1):19-26.
24. Goudah, A.; Sher Shah, S.; Shin, HC.; Shim, JH.; Abd El-Aty,
AM. Pharmacokinetics and mammary residual depletion
of erythromycin in healthy lactating ewes. J Vet. Med. (A).
2007; 54 (10): 607-611.
25. Guardabassi, L.; Apley, M.; Olsen, J.E.; Toutain, P.L.; Weese,
S. Optimization of antimicrobial treatment to minimize
resistance selection. En: Moller Aarestrup, F.; Schwarz, S.;
Shen, J.; Cavaco, L. (eds.). Antimicrobial Resistance in Bacteria
from livestock and companion animals. American Society for
Microbiology, Washington D.C., USA. 2018; 637-673.
26. Jacobs, M.R. Optimisation of antimicrobial therapy using
pharmacokinetic and pharmacodynamic parameters.
Clin Microbiol Infect. 2001;7:589-596.
27. Kreil, V. E.; Ambros, L.; Montoya, L.; Hallu, R.; Rebuelto,
M.; Bramuglia, G.. Pharmacokinetics of sodium
and trihydrate amoxicillin after intravenous and
intramuscular administration in llamas (Lama glama).
Small Rumin Res. 2012;102(2-3), 208-212.
28. . Kreil, V.; Prados, A. P.; Ambros, L.; et al. Farmacocinética
comparativa de una dosis única de ampicilina en llamas
luego de la administración intravenosa, intramuscular y
subcutánea. Archivos Med Vet. 2014; 46(2), 271-276.
29. Kreil, V.; Ambros, L.; Prados, A. P.; et al. Pharmacokinetics
of immediate and sustained release cephalexin
administered by different routes to llamas (Lama glama).
Adv Pharm Sciences. 2016; Article ID 4621039.
30. Madaras-Kelly, K.J.; Ostergaard, B.E.; Baeker Hovde,
L.; Rotschafer, J.C. Twenty-four-hour area under the
concentration-time curve/MIC ratio as a generic
predictor of fluoroquinolone antimicrobial effect by
using three strains of Pseudomonas aeruginosa and an
in vitro pharmacodynamic model. Antimicrob Agents
Chemother. 1996; 40:627-632.
31. . McKellar, Q.A.; Sanchez Bruni, S.F.; Jones, D.G.
Pharmacokinetic/pharmacodynamic relationships of
antimicrobial drugs used in veterinary medicine. J Vet
Pharmacol Therap. 2004; 27:503-514.
32. Mouton, J.W.; Ambrose, P.G.; Canton, R.; et al. Conserving
antibiotics for the future: new ways to use old and new
drugs from a pharmacokinetic and pharmacodynamic
perspective. Drug Resist Updat. 2011;14(2):107-17. doi:
10.1016/j.drup.2011.02.005.
33. Papich, M.G. Antibiotic treatment of resistant infections in
small animals. Vet Clin Small Anim. 2013; 43:1091-1107.
34. Papich, M.G. Pharmacokinetic-pharmacodynamic (PKPD) modeling and the rational selection of dosage
regimes for the prudent use of antimicrobial drugs.
Vet Microbiol. 2014; 171(3-4):480-486. doi: 10.1016/j.
vetmic.2013.12.021.
35. Papich, M.G. Antimicrobial agent use in small animals
what are the prescribing practices, use of PK-PD
principles, and extralabel use in the United States? J Vet
Pharmacol Therap. 2020; 00:1-12.
36. Passini, S.; Montoya, L.; Aramayona, S.; Lorenzini, P.;
Albarellos, G. Aplicación de los modelos farmacocinéticos/
farmacodinámicos al uso de clindamicina en felinos
domésticos para el tratamiento de infecciones
estafilocócicas. XX Congreso Nacional AVEACA, 2020.
Buenos Aires, Argentina.
37. Passini, S.M.; Stranges, A. ; Montoya, L. ; et al. Optimización
terapéutica del uso de clindamicina en caninos según
los modelos farmacocinéticos/farmacodinámicos. 1ras
Jornadas INCLIVET Instituto de investigaciones clínicas
veterinarias, 2021. Buenos Aires, Argentina.
38. Rybak, MJ.; Abate, BJ.; Kang, SL.; Ruffing, MJ.; Lerner,
SA.; Drusano, GL. Prospective evaluation of the effect of
an aminoglycoside dosing regimen on rates of observed
nephrotoxicity and ototoxicity. Antimicrob Agents
Chemother. 1999; 43:1549-55.
39. Sánchez Larrañaga, J.; Kreil, V.; Esmoris, S.; Veksler Hess,
J.; Ambros, L. Marbofloxacin pharmacokinetics in goats
during the lactation. Small Rum Res. 2019; 179:26-29.
40. . Toutain, P.L.; Del Castillo, J.R.E.; Bousquet-Melou, A.
The pharmacokinetic pharmacodynamic approach to a
rational dosage regimen for antibiotics. Res Vet Sci. 2002;
73:105-114.
41. Toutain, P.L.; Pelligand, L.; Lees, P.; Bousquet-Mélou,
A.; Ferran, A.A.; Turnidge, J.D. The pharmacokinetic/
pharmacodynamic paradigm for antimicrobial drugs
in veterinary medicine: Recent advances and critical
appraisal. J Vet Pharmacol Ther. 2021; 44:172-200. doi:
10.1111/jvp.12917.
42. Turnidge, J.D. The pharmacodynamics of 𝛽-lactams. Clin
Infect Dis. 1998; 27:10-22.
43. Van Bambeke, F.; Tulkens, PM. Macrolides:
pharmacokinetics and pharmacodynamics. Int. J.
Antimicrob. Agents. 2001; 1:17-23.