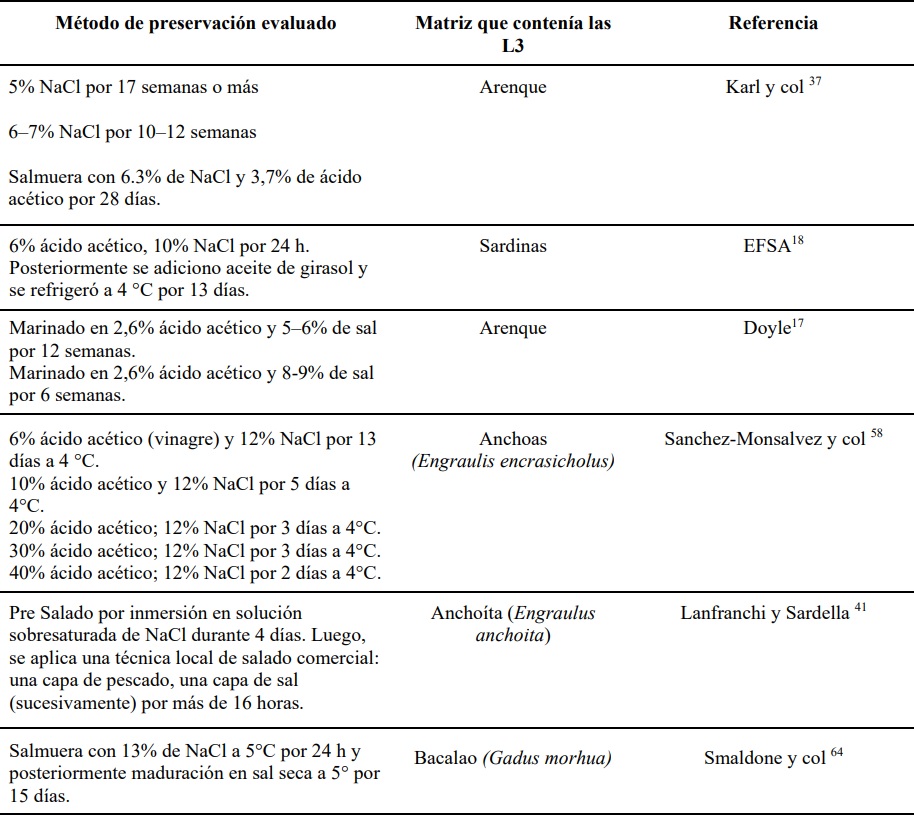
Tabla 1:: Métodos de preservación evaluados que lograron el 100% de inactivación de L3 de anisakidos presentes en diferentes especies de pescados.
REVISIÓN BIBLIOGRÁFICA
Métodos de inactivación de parásitos presentes en pescados comercializados para consumo humano
Fariña, FA1,2; Pasqualetti, MI1,2; Aronowicz, T1; Ercole, M1,2; Bessi, C1,2;alvarez, M3,4; Lopez, F5; Volpedo, A2; Ribicich, MM1,2
1
Universidad de Buenos Aires, Facultad de Ciencias Veterinarias, Cátedra de Parasitología y Enfermedades Parasitarias. Buenos
Aires, Argentina.
2
CONICET–Universidad de Buenos Aires, Facultad de Ciencias Veterinarias, Instituto de Investigaciones en
Producción Animal (INPA), Buenos Aires, Argentina.
3 Dirección de Planificación Pesquera. Subsecretaría de Pesca y Acuicultura.
MAGYP.
4 Licenciatura en Gestión Ambiental. Universidad Nacional de Moreno. 5
Universidad de Buenos Aires, Facultad de
Ciencias Veterinarias.
Recibido: 31/08/2021
Aceptado: 19/10/2021
Correspondencia e-mail:Mabel Ribicich mribicich@fvet.uba.ar
Resumen
La prevención y el control de las parasitosis constituyen eslabones fundamentales en las diferentes etapas del proceso productivo de la industria pesquera, debido a que estos agentes pueden causar importantes problemas económicos y riesgos para la salud. Existen ciertas especies de parásitos que poseen un efecto devastador en la producción acuícola, ya que encuentran en las estaciones de cría, el lugar ideal para reproducirse. En consecuencia, es necesario utilizar tratamientos de inactivación adecuados para garantizar la calidad del producto alimenticio, conservar sus características organolépticas y evitar el contagio de las personas por parásitos zoonóticos. Se realizó una búsqueda bibliográfica con el objetivo de describir los principales métodos de inactivación de parásitos zoonóticos reportados en Argentina. La congelación, cocción, salazón, marinado, ahumado e irradiación constituyen tratamientos postulados para asegurar la inocuidad de diversos productos y subproductos pesqueros cuando son aplicados bajo determinadas condiciones. Las regulaciones sobre parasitosis, guías y documentos para la industria y educación de los consumidores constituyen estrategias fundamentales para producir alimentos seguros para la población.
Palabras clave: parásitos, inactivación, zoonosis, peces, ETA
A review on the inactivation methods of parasites present in fish intended for human consumption
Summary
The prevention and control of parasites are essential tasks in the fishing industry that tend to avoid significant economic problems and health risks. There exists some parasites that have a devastating effect on aquaculture, since they find the ideal place to reproduce in the breeding stations. Consequently, it is necessary to use appropriate inactivation methods on fish to guarantee the quality of the food product, preserve its organoleptic characteristics and avoid the contagion of people by zoonotic parasites. To this end, a bibliographic search was carried out in order to describe the main methods of inactivation of zoonotic fish borne parasites reported in Argentina. Freezing, cooking, salting, marinating, smoking and irradiation are postulated as possible treatments to ensure the safety of various fish products and by-products when they are applied under certain conditions. Regulations on parasites, guides and documents for industry and consumer education constitute fundamental strategies to produce safe food for the population.
Key words: parasites, inactivation, zoonoses, fishes, FBD
INTRODUCCIÓN
Se estima que la producción de pescado a
nivel mundial alcanzó unos 179 millones de toneladas en 2018. De ese total, la acuicultura aportó
el 46 %, y el 52 % tuvo como destino el consumo
humano25. La ingesta de pescado en el mundo en
el año 2018 fue de 20,5 kg per cápita.
Existe una tendencia al aumento del consumo de este tipo de productos y según la FAO en
el año 2017, el pescado representó el 17 % de la
proteína de origen animal que se consume y el 7
% de todas las proteínas consumidas en el mundo.
La captura pesquera en Argentina, para
el año 2020 fue de 790.000 t anuales, siendo las
especies más importantes de peces la merluza
común (Merlucius hubbsi), especies del variado
costero, siendo las más importantes la corvina
(Micropogonias furnieri), la pescadilla (Cynoscion
guatucupa), el besugo (Pagrus pagrus), la caballa
(Scomber japonicus), las rayas en general y de ambientes continentales el sábalo (Prochilodus lineatus) y la boga (Megaleporinus obtusidens). El 58 %
de las parasitosis transmitidas por los alimentos
listadas según el ranking de riesgo de la FAO/
WHO en 2012 pueden estar asociadas al consumo
de alimentos de origen animal, entre las que se
encuentran aquellas parasitosis vinculadas con el
consumo de animales marinos y dulceacuícolas70.
Los peces son hospedadores de diversos
parásitos, que, según el agente involucrado, pueden tener un impacto negativo en el producto pesquero y/o en la salud de las personas. La mayoría
de estos organismos son encontrados durante el
procesamiento del pescado en los órganos que se
descartan, sin embargo muchos pueden estar presentes en el tejido muscular54.
En los últimos años, el consumo de pescado crudo se ha convertido en una tendencia culinaria gracias al aumento de la popularidad del
sushi, ceviche, sashimi, gravlax, entre otros, lo que
podría traer como consecuencia un incremento en
el riesgo de exposición de los consumidores a las
parasitosis transmitidas por estos productos53.
Las zoonosis parasitarias asociadas al
consumo de productos pesqueros crudos o insuficientemente cocidos pueden ser causadas por nematodes, cestodes, trematodes, acantocéfalos, entre otros y dentro de estos grupos, los anisákidos,
constituyen los nematodes más frecuentes desde
el punto de vista sanitario12, 45, 66.
Las larvas de los nematodes pertenecientes a la familia Anisakidae se encuentran ampliamente distribuidas en distintas poblaciones de
peces a lo largo del mundo38, 43, 46. Dentro de esta
familia encontramos géneros zoonóticos como
Anisakis spp., Pseudoterranova spp. y Contracaecum spp. Estos tienen un ciclo de vida acuático
que involucra a crustáceos como primeros hospedadores intermediarios y como segundos hospedadores intermediarios, en el caso de Pseudoterranova y Contracaecum, a los peces, y peces
y calamares en el caso de Anisakis1,33,34,39,40. Los
ejemplares adultos de Contracaecum, se encuentran comúnmente en distintos tipos de lobos marinos y aves piscívoras44, mientras que las especies
de los géneros Anisakis y Pseudoterranova pueden
tener como hospedadores definitivos a cetáceos y
pinnípedos respectivamente32, 63.
Las personas pueden contraer la infección
por anisákidos al consumir productos pesqueros
que contienen larvas L3, las que pueden penetrar
en la mucosa gastrointestinal y causar dolor abdominal severo, náuseas, vómitos, y diarrea3
. Sin
embargo, en la infección por estos parásitos, lo
más frecuente es observar en los pacientes una
respuesta alérgica, que puede desencadenar síntomas clínicos que van desde la aparición de urticaria hasta shock anafiláctico13. La anisakiosis es
una enfermedad zoonótica muy importante, habiéndose reportado un aumento sustancial en su
prevalencia en las últimas dos décadas a lo largo
de todo el mundo13.
Dibothriocephalus y Adenocephalus son
dos agentes parasitarios que pertenecen a la familia Diphyllobothriidae cuyos estadios adultos
pueden infectar a las personas y producir vómitos,
eosinofilia, diarrea, dolor abdominal y anemia42, 55.
Sus ciclos biológicos se encuentran íntimamente
conectados con los ambientes acuáticos. Las aves
ictiófagas y los carnívoros domésticos y silvestres
como perros, gatos, zorros y visones, entre otros,
también pueden actuar como hospedadores definitivos de Dibothriocephalus, mientras que los
lobos marinos como hospedadores de Adenocephalus. Los copepódos y los peces actúan como
primeros y segundos hospedadores intermediarios respectivamente 61, 69.
Los acantocéfalos de los géneros Bolbosoma y Corynosoma son parásitos que tienen un
ciclo de vida del tipo predador-presa en donde
los cetáceos y pinípedos albergan en su intestino a los estadios adultos, actuando como hospedadores definitivos, mientras que los crustáceos
actúan como primeros hospedadores intermediarios y los peces como segundos hospedadores
intermediarios. Si bien los casos documentados
de infecciones humanas son escasos y se circunscriben principalmente a Japón, se estima que esta
enfermedad podría surgir en cualquier parte del
mundo, debido al consumo de peces o calamares
crudos con cistacantos 26, 35,48,60.
Ascocotyle longa es un digeneo donde los
mamíferos y aves acuáticas actúan como hospedadores definitivos y los moluscos y peces como
hospedadores intermediarios59. Se han reportado
casos ocasionales en seres humanos14.
En Argentina, las enfermedades parasitarias transmitidas por el consumo de productos pesqueros no son eventos de notificación obligatoria,
por lo que no existen estadísticas oficiales sobre el
impacto de las mismas en la población humana.
La presente revisión tiene como objetivo
describir los principales métodos de inactivación
de parásitos zoonóticos reportados en Argentina.
Si bien A. simplex sólo fue descrito en el hemisferio norte hasta el presente, se han incorporado
los trabajos realizados sobre este parásito ya que
aportan la mayor fuente de información sobre los
efectos de métodos de inactivación en anisakidos.
TRATAMIENTOS DE INACTIVACIÓN
La congelación, cocción, salazón, marinado, ahumado e irradiación constituyen tratamientos postulados para asegurar la inocuidad de diversos productos y subproductos pesqueros.
Congelación
La congelación es uno de los métodos más
conocidos que existen para extender la vida útil de
los alimentos ya que permite detener o inhibir los
procesos microbiológicos y enzimáticos que los modifican. Es un método convencional y de fácil aplicación que mantiene la estabilidad de los alimentos sin
perder la calidad inicial36. La congelación influye en
el estado físico del alimento debido a la transformación del agua en hielo. Para ello se requiere una temperatura de alrededor de -18 ° C 15, 52.
Una forma eficaz de inactivar larvas de
anisakidos es el procesamiento térmico de productos pesqueros a temperaturas bajo cero. Sin
embargo, algunos estudios han revelado que estos
parásitos tienen la capacidad de sobrevivir a la
congelación a temperaturas por debajo de 0 °C3, 47,
71. En el caso de Anisakis spp., Wharton y Aalders71
atribuyen este fenómeno a la producción de trehalosa, que tendría un efecto crioprotector.
En un estudio realizado por Podolska y
col50, los autores evaluaron la capacidad para inactivar larvas aplicando distintas condiciones de
frío (temperaturas, tiempos y equipos) sobre filetes de bacalao del Atlántico (Gadus morhua) y sobre arenque (Clupea harengus) entero (sin extraer
órganos) naturalmente infectados con A. simplex
y Pseudoterranova spp. Los autores encontraron
que las larvas de A. simplex y Pseudoterranova
spp. presentes en los filetes murieron a partir de
-15 °C. Sin embargo, no todas las larvas de A. simplex murieron en el pescado entero sometido a las
condiciones de temperatura -15, -18 y -20 °C por
24 h. En otro estudio realizado en salmones rojos
(Oncorhynchus nerka) enteros y eviscerados y peces roca canarios (Sebastes pinniger) enteros naturalmente infectados, se estudió el efecto de las
condiciones de ultracongelación en la viabilidad
de larvas de A. simplex. No se encontraron larvas
viables luego de someter a los pescados a -35 °C
durante 24, 48 o 72 h16.
Algunos autores encontraron que el tiempo necesario para eliminar las larvas es directamente proporcional a la temperatura de congelación. Adams y col.3
determinaron que el tiempo
mínimo requerido para eliminar A. simplex presentes en filetes de lenguado de diente de flecha (Atheresthes stomias) sometidos a temperaturas de - 15,
-20, -30 y -40 °C fue de 96, 60, 12 y 9 h, respectivamente. Por otro lado, Oh y col47 evaluaron la viabilidad de larvas de Anisakis provenientes de vísceras
de congrio (Conger myriaster) que fueron extraídas
e introducidas experimentalmente en calamares
(Sepioteuthis sepioidea) y abadejos de Alaska (Theragra chalcogramma) y evidenciaron la inactivación de todas las larvas sometidas a las siguientes
condiciones: -20 °C por 48 h y -40 por 24 h.
La capacidad del frío para inactivar estadios
inmaduros de cestodes en peces no se encuentra
ampliamente documentada en la bibliografía científica. Titova65 sugirió que el tiempo de congelación
requerido para matar los plerocercoides de Diphyllobothrium latum (actualmente Dibothriocephalus
latus) presentes en lucios (Esox lucius) sería directamente proporcional al peso del pescado. A una temperatura de exposición de -6 °C fueron necesarios 7
días para un animal de 9 kg mientras que 2 días para
uno de 700 g. Feachem y col20 señalan que la temperatura de -10 °C durante 8 a 72 h dependiendo del
grosor del pescado permite la inactivación de plerocercoides de Diphyllobothrium latum. Sin embargo,
en otro estudio realizado sobre plerocercoides de
Diphyllobothrium presentes en distintas especies de
peces de agua dulce cuyos pesos estaban comprendidos entre 16,7 g a 2460 g, se determinó que a las
24 h de exposición a -18 °C los estadios larvarios
fueron inactivados, independientemente del tamaño
del pescado analizado31.
Estudios realizados en plerocercoides
libres extraídos de su matriz dan cuenta que la
acción del frío a una temperatura de -10 °C resultó en la pérdida de infectividad de estas formas
juveniles19, 56.
Calor
El calor es uno de los métodos más confiables28 y ampliamente utilizados, y, al igual
que la congelación, permite la inactivación de
microorganismos y enzimas presentes en los
alimentos. Al utilizar este tratamiento, se pueden producir alimentos de larga vida útil que
pueden no requerir refrigeración posterior.
También es fácil controlar las condiciones del
proceso durante el tratamiento, siempre que se
cuente con los instrumentos adecuados. Otras
ventajas citadas son la destrucción de algunos
elementos antinutricionales que pueden estar
presentes en los alimentos y la facilidad de digestión y absorción de algunos de los nutrientes
(por ejemplo: facilitación de la digestión de proteínas, gelatinización de almidón)7, 8.
La cocción a una temperatura igual o
mayor a 60 °C por un minuto sería suficiente
para eliminar larvas de Anisakis spp.10. Sin embargo, Sanchez Alonso y col57, realizaron una
experiencia para evaluar el efecto de distintas
condiciones de temperaturas y tiempos sobre
Anisakis spp. Para ello, inocularon experimentalmente filetes de merluza (Merluccius merluccius) con larvas de Anisakis spp. Estos autores
encontraron que, en algunas de las muestras
que alcanzaron los 60 °C en el centro térmico
durante un minuto, esta condición no fue suficiente para eliminar la totalidad de las L3 de
Anisakis, necesitando al menos 8 minutos.
Al igual que lo expuesto previamente para
el tratamiento por congelación, diversos autores
estudiaron la relación del grosor del filete/pescado entero y el tiempo y temperatura requeridos
para inactivar los estadios infectantes de anisakidos. En este sentido, se sugirió que para filetes de
30 mm de grosor, una temperatura de 70 ° C durante 7 min o de 60 °C durante 10 min sería eficaz
para matar larvas de Pseudoterranova decipiens
presentes en el bacalao. Gago Cabezas27 remarcó
que sería necesario aplicar unos 60 °C por 10 a 12
minutos por pulgada (2,54 cm) de grosor del pescado para producir la inactivación.
El efecto del calor sobre metacercarias de
Ascocotyle longa presentes en lisas (Mugil spp.)
fue analizado por algunos investigadores. Borges
y col.11 encontraron que es necesaria una temperatura de por lo menos 60 °C por 15 minutos para
eliminar las metacercarias inoculadas experimentalmente en filetes de Mugil liza. Por otro lado, Rodriguez y col54 estudiando filets de Mugil platanus
naturalmente infectados, reportaron que a una
temperatura de 55 °C por 1 minuto en el centro
del producto se produjo la inactivación de las metacercarias de A. longa.
Según Salminen56, los plerocercoides de
D. latum pueden ser inactivados a una temperatura de 56 °C por 5 minutos. Peduzzi y Boich49
señalan que la cocción a 50 °C durante 10 minutos permite la inactivación de plerocercoides
de D. latum.
Los hornos a microondas permiten cocinar o calentar los alimentos de manera simple,
rápida, y práctica. Su funcionamiento involucra
mecanismos iónicos y dieléctricos. A lo largo del
tiempo se han realizado diversos estudios con el
fin de evaluar el efecto de las microondas sobre
patógenos presentes en alimentos. Lanfranchi y
Sardella41 estudiaron el efecto de las microondas
sobre filetes de pescado en forma de sándwich
experimentalmente inoculados con Anisakis
spp. Para ello, utilizaron un horno microondas
comercial al 75 % de poder (600 W) durante 1
minuto, y evidenciaron la ausencia de larvas vivas cuando la temperatura interna del producto
fue de 75,56 °C. Vidaček y col68 también observaron la inactivación de larvas de Anisakis spp.
experimentalmente inoculadas en sandwiches
de filetes de merluza (Merluccius merluccius)
pero a temperaturas de 60 °C (800 W) y 70 °C
(1000 W) durante 5 y 3 minutos respectivamente. Por otro lado, Adams y col.2 estudiaron
el efecto de las microondas de un horno comercial al 100 % de poder (700W) sobre filetes de
Atheresthes stomias naturalmente infectados y
sobre sandwiches de filetes experimentalmente inoculados con Anisakis spp., que a diferencia de los anteriores fueron rotados durante su
procesamiento. Los autores encontraron que el
porcentaje de supervivencia de las larvas de A.
simplex a una misma temperatura fue menor en
los sandwiches que en los filetes. Los nematodes no sobrevivieron cuando la temperatura interna en los sándwiches y filetes fue ≥ 65 °C o 77
°C, respectivamente2.
Salazón y marinado
Son métodos tradicionales que permiten
la preservación del pescado y podrían lograr inactivar larvas de nematodes. Existen estudios sobre
los efectos de distintas concentraciones de NaCl
(sal común) y ácido acético en diferentes tipos de
preparaciones con pescados que permiten inactivar los parásitos presentes en ellos.
Algunos países como España y Francia
determinaron condiciones técnicas de salado y
marinado que permiten la inactivación de las larvas de parásitos. En España, el Comité Científico
de Agencia Española de Seguridad Alimentaria
y Nutrición (AESAN) aseveró que el tratamiento
por congelación no es necesario para aquellos
productos pesqueros que alcancen una concentración de NaCl por encima del 9 % por al menos 6 semanas, entre 10-20 % por 4-5 semanas o
más del 20 % por un mínimo de 3 semanas4
. En
cuanto al salado, la Agencia Francesa de Seguridad Alimentaria (AFSSA), reportó que para preparaciones tradicionales y para pequeñas cantidades, los niveles de salinidad del 20 % producen
la inactivación del parásito en 21 días, mientras
que concentraciones del 15 % requieren 28 días.
AFSSA también señala que el marinado con 10%
de ácido acético y 12 % de sal, mantenido por 5
días a 4 °C, no es peligroso para la salud, así como
productos pesqueros con porcentajes de sal entre el 6 % y el 12 % de ácido acético por 13 días a
4 °C18. En la tabla 1 se resumen los trabajos realizados por distintos autores.
Si bien este tipo de procesamiento puede
resultar ventajoso en circunstancias en las que no
se dispone de energía eléctrica, la salazón y el marinado pierden sus propiedades larvicidas si las
concentraciones de NaCl y / o ácido acético son
insuficientes o cuando los tiempos de contacto
son demasiado cortos37.
Ahumado
Es un proceso que utiliza el humo que se obtiene por la combustión de la madera, con un aporte limitado de aire. Tiene como finalidad no solo la conservación del alimento sino también conferir sabor al producto. Las técnicas de ahumado se pueden clasificar en: ahumado en frío y ahumado en caliente.
Tabla 1:: Métodos de preservación evaluados que lograron el 100% de inactivación de L3 de anisakidos presentes
en diferentes especies de pescados.

El ahumado en frío se puede utilizar como
potenciador del sabor, por ejemplo, para el salmón
o las vieiras, y las temperaturas para este proceso
se mantienen por debajo de 38 °C. El proceso dura
desde unas pocas horas hasta varios días. La evidencia señala que luego del ahumado del salmón
(Onchorhynchus keta) naturalmente infectado con
Anisakis spp. a una temperatura de 25.6 °C por 12
h las larvas permanecen vivas29. Resultados similares fueron reportados en arenque del Pacífico
(Clupea harengus pallasi), donde las larvas de A.
simplex se mantuvieron viables luego de un tratamiento previo en salmuera y ahumados a una temperatura promedio de 19 °C por 24 h30.
Por otro lado, el ahumado en caliente
expone los alimentos al humo y al calor en un
ambiente controlado. Los productos se someten a temperaturas de 70°C a 80°C por 3 a 8 h51.
Las larvas de A. simplex son destruidas bajo tales
condiciones23. De la misma manera, Salminen56
encontró que el efecto del ahumado sobre plerocercoides de D. latum en peces depende solo de las
altas temperaturas, mientras que el efecto de los
constituyentes del humo fue considerado de menor importancia.
Cabe destacar que el sabor ahumado no
implica necesariamente que se haya aplicado el
tratamiento tecnológico correspondiente, sino
que en algunos casos corresponde a la aplicación
de un saborizante llamado humo líquido, con lo
cual sería necesario aplicar los tratamientos inactivantes arriba mencionados.
Irradiación
La irradiación (aplicación de radiación
ionizante) es una tecnología que mejora la seguridad y la vida útil de los alimentos, mediante la
disminución o eliminación de los microorganismos presentes en ellos. Es uno de los métodos más
importantes para la preservación de alimentos.
Arvanitoyannis y col.6
señalan que la irradiación es un método de bajo costo y muy efectivo
que permite prolongar la vida media de los productos pesqueros de 3 a 5 veces más que los métodos tradicionales.
El efecto de los rayos gamma difiere según el parásito, el estadio parasitario y el tipo de
alimento, lo que se refleja en la amplia variación
de la dosis efectiva mínima necesaria para producir la inactivación de estos organismos.
van Mameren y Houwing67 encontraron
que para inactivar Anisakis spp. en arenque salado
eran necesarias dosis de 6 a 10 kGy. En un estudio
realizado en anguila de mar (Anago anago), Seo
y col.62 no pudieron inactivar las larvas de tercer
estadio de A. simplex con una dosis de irradiación
mayor a 1 kGy. Resultados similares fueron arrojados por otro estudio donde se observó que las
larvas de A. simplex fueron altamente resistentes a
dosis de irradiación de 2 a 10 kGy24.
El efecto de la irradiación con dosis de 1
a 10 kGy sobre A. longa presentes en lisas (Mugil
sp) fue estudiado por Antunes y col.5
, quienes reportaron que 4 kGy sería la dosis necesaria para
controlar el A. longa, sin modificar el olor, color o
la apariencia interna o externa del pescado.
La información que existe en cuanto a la
modificación de las características organolépticas
luego de la exposición de los productos pesqueros
a la irradiación, con el propósito de la inactivación
de nematodes es inconsistente9
.
DISCUSIÓN Y CONCLUSIONES
A partir de los trabajos científicos analizados se observó que los métodos de inactivación de
parásitos presentes en productos pesqueros que
contribuyen a disminuir el riesgo de ictiozoonosis y
que se encuentran más fácilmente al alcance del consumidor serían la congelación y la cocción térmica.
La eficacia de la congelación de los productos pesqueros depende de muchos factores,
por ejemplo, la especie de pescado (si es graso o
magro), el tipo de materia prima (si son filetes o
pescado entero), la masa y el volumen del producto pesquero, la potencia y el porcentaje de ocupación de la fuente generadora de frío 3, 16, 50, 71.
El tratamiento para eliminar parásitos
viables en productos pesqueros destinados al consumo humano es obligatorio en muchos países de
la UE, Estados Unidos y Canadá. La normativa europea (Reglamento de la UE n.° 1276/2011) exige
que los operadores de empresas alimentarias aseguren que la materia prima o el producto terminado se someta a un tratamiento de congelación
para eliminar los parásitos viables que pueden suponer un riesgo para la salud del consumidor. En
el caso de parásitos distintos de los trematodes,
el tratamiento de congelación debe consistir en
bajar la temperatura en todas las partes del producto como mínimo al menos a – 20 °C durante 24
horas a – 35 °C durante 15 horas.
La Administración de Drogas y Alimentos de los EE. UU. (FDA) recomienda que todos los
mariscos y pescados destinados al consumo crudo
deben congelarse rápidamente a -35 °C o menos durante 15 horas o congelarse regularmente a -20 °C o
menos durante 7 días 22.
En Argentina, la orden de servicio (OS)
N°8/2012 establece la obligatoriedad para las
empresas del congelamiento como método para
combatir a Anisakis, reconocido en el Reglamento
1276/2011 de la UE como el parásito implicado
en problemas de salud.
El pescado crudo, marinado, o parcialmente cocido, debería ser tratado, según las recomendaciones internacionales para garantizar la
inactivación de larvas de anisakidos así como de
plerocercoides de D. latus. Dado que el rango de
congelación en los freezers domésticos va desde
los -6 °C hasta los -24 °C de temperatura promedio, de 1 a 4 estrellas (* a ****), y que las temperaturas efectivas para inactivar las larvas de nematodes anisákidos son a partir de los -20° C, sólo
los freezers clasificados como de tres (***) o más
estrellas son recomendados para este propósito,
siempre y cuando su funcionamiento sea óptimo.
Los autores concuerdan que la cocción
a temperaturas mayores a 60° C en el centro del
pescado por al menos 1 minuto es suficiente
para inactivar parásitos. Estos resultados se condicen con lo señalado por la normativa de la UE
1276/2011. Sin embargo, la FDA22 señala que los
pescados deberían cocinarse adecuadamente hasta alcanzar una temperatura interna de aproximadamente 63°C. El tiempo necesario para alcanzar
la temperatura de inactivación dependerá del espesor de la pieza 16, 27.
En cuanto a la cocción en horno a microondas, la evidencia2, 41, 68 señala que bajo determinadas condiciones se puede producir la inactivación de anisakidos. Sin embargo, hay que tener
en cuenta varios factores como por ejemplo la potencia utilizada, el tamaño de la pieza, la rotación,
su cobertura, que incidirán en el resultado final. Al
respecto, la normativa UE 1276/2011 no la menciona, mientras que la FDA21 recomienda cubrir
el producto, que la temperatura alcance los 74 °C,
rotarlo a la mitad de la cocción y dejarlo reposar
por 2 minutos.
La bibliografía analizada sobre el salado y
marinado de los productos pesqueros, demuestra
que bajo determinadas condiciones estos métodos podrían ser utilizados con el fin de inactivar
larvas de anisakidos. Sin embargo, debido a que es
necesario contar con el equipamiento adecuado
para determinar y monitorear las concentraciones de sal y ácido durante todo el proceso, es recomendable congelar previamente la materia prima,
especialmente en preparaciones caseras o que involucren un nivel inadecuado de tecnificación.
El ahumado en frío no sería un método
apropiado para inactivar parásitos, debiéndose
combinar previamente con la congelación para
garantizar la inocuidad del alimento. En contraste, el ahumado en caliente sería efectivo siempre y
cuando se cumplan con la temperatura y el tiempo necesarios para inactivar anisakidos y plerocercoides de D. latus presentes en los productos
pesqueros.
Dependiendo la matriz utilizada, la bibliografía señala que la irradiación sería efectiva
en un rango de dosis desde los 2 kGy hasta 10 kGy.
Sin embargo, los datos que existen en la literatura
resultan insuficientes para demostrar si son efectivos como métodos alternativos a la congelación.
Del análisis de la bibliografía encontramos que distintos métodos han demostrado ser
eficaces para inactivar los estadios infectantes de
los parásitos transmitidos por productos pesqueros. Sin embargo, entendemos que la implementación de muchos de ellos por parte de los elaboradores de productos alimenticios artesanales
puede resultar dificultosa, lo que podría derivar
en un incremento del riesgo de infección para el
consumidor. Asimismo, encontramos que la mayor parte de la evidencia científica que sustenta el
empleo de tecnologías para la inactivación de parásitos refiere a anisakidos. Por ello, creemos que
es necesario ahondar en el estudio de los métodos
de control sobre estos y otros parásitos presentes
en peces de Argentina y de riesgo zoonótico.
AGRADECIMIENTOS
El presente trabajo fue financiado por los proyectos 20020190200396BA, 20020170100530BA, PICT 2015– 2350 y PICT-2018- 01203.
1. Abollo, E.; Gestal, C.; Pascual, S. Anisakis infestation in marine fish and cephalopods from Galician waters: an updated perspective. J Parasitol Res, 2001; 87(6), 492-499.
2. Adams, A. M.; Miller, K. S.; Wekell, M. M.; Dong, F. M. Survival of Anisakis simplex in microwave-processed arrowtooth flounder (Atheresthes stomias). J Food Prot, 1999;
62(4), 403-409.
3. Adams, A. M.; Ton, M. N.; Wekell, M. M.; MacKenzie, A. P.;
Dong, F. M. Survival of Anisakis simplex in arrowtooth
flounder (Atheresthes stomia) during frozen storage.
J Food Prot, 2005; 68(7), 1441-1446.
4. AESAN. Informe del Comité Científico de la Agencia Española de Seguridad Alimentaria y Nutrición (AESAN)
sobre medidas para reducir el riesgo asociado a la presencia de Anisakis. 2007.
5. Antunes, S. A.; Wiendl, F. M.; Dias, E. A.; Arthur, V.; Daniotti, C. Gamma ionization of Phagicola longa (Trematoda:
Heterophyidae) in mugilidae (pisces) in Sao Paulo, Brazil.
Radiat Phys Chem Oxf Eng, 1993; 42(1-3), 425-428.
6. Arvanitoyannis, I. S.; Stratakos, A.; Mente, E. Impact of
irradiation on fish and seafood shelf life: a comprehensive review of applications and irradiation detection. Crit
Rev Food Sci Nutr, 2008; 49(1), 68-112.
7. Augusto, P. E.; Soares, B. M.; Castanha, N. Conventional
technologies of food preservation. In Innovative Technologies for Food Preservation, 2018; 3-23. Academic Press.
8. Awuah, G. B.; Ramaswamy, H. S.; Economides, A.. Thermal
processing and quality: Principles and overview. Chemical Engineering and Processing: Process Intensification,
2007; 46(6), 584-602.
9. Beldsoe, G. E.; Oria, M. P. Potential Hazards in Cold‐Smoked
Fish: Parasites. J Food Sci, 2001; 66, S1100-S1103.
10. Bier, J. W. Experimental anisakiasis: cultivation and temperature tolerance determinations. J Milk Food Technol.,
1976; 39(2), 132-137.
11. Borges, J. N.; Lopes, K. C.; Santos, C. P. Viability of Ascocotyle (Phagicola) longa (Trematoda: Heterophyidae)
metacercariae from mullets (Mugil liza) from Rio de Janeiro, Brazil after exposure to freezing and heating in the
temperature range from− 35° C to 180° C. Food control,
2018; 89, 117-122.
12. Butt, A. A.; Aldridge, K. E.; Sander, C. V. Infections related
to the ingestion of seafood. Part II: parasitic infections
and food safety. Lancet Infect Dis, 2004; 4(5), 294-300.
13. Chai, J. Y.; Murrell, K. D.; Lymbery, A. J. Fish-borne parasitic zoonoses: status and issues. Int J Parasitol, 2005;
35(11-12), 1233-1254.
14. Chai, J. Y.; Jung, B. K. Fishborne zoonotic heterophyid infections: an update.
Food Waterborne Parasitol, 2017; 8, 33-63.
15. Cheng, L.; Sun, D. W.; Zhu, Z.; Zhang, Z. Emerging techniques for assisting and accelerating food freezing processes: A review of recent research progresses. Crit
Rev Food Sci Nutr, 2017; 57(4), 769-781.
16. Deardorff, T. L.; Throm, R. Commercial blast-freezing of
third-stage Anisakis simplex larvae encapsulated in salmon and rockfish. J Parasitol, 1988; 600-603.
17. Doyle ME. Foodborne Parasites: A Review of the Scientific Literature Review Fri Briefings. Madison (WI):
University of Wisconsin-Madison; 2003. En: https://fri.
wisc.edu/files/Briefs_File/parasites.pdf, consultado 20
de agosto de 2021.
18. EFSA Panel on Biological Hazards (BIOHAZ). Scientific
opinion on risk assessment of parasites in fishery products. EFSA journal, 2010; 8(4), 1543.
19. Eguchi, S. Diphyllobothrium latum (Linnaeus, 1758), Prog.
Med. Parasitol. Jpn., 5, 129, 1973.
20. Feachem, R. G.; Bradley, D. J.; Garelick, H.; Mara, D. D. Sanitation and disease: health aspects of excreta and wastewater management. John Wiley and Sons. 1983.
21. Food and Drug Administration (FDA). Food code, sections
3–401.11 (A1) and 3–401.12. In 1997 recommendations
of the United States Public Health Service Food and Drug
Administration. U.S. Food and Drug Administration, Washington, D.C. 1997.
22. Food and Drug Administration (FDA) (USA). Chapter 5:
Parasites. In Fish and fishery products: hazards and controls guidance. 2011
23. FDA/CFSAN. Fish and Fisheries products hazards and
controls guide. (2001). Processing parameters needed to
control pathogens in cold smoked fish. Potential hazards
in cold-smoked fish: Parasites. U.S. Food and Drug Administration. Center for Food Safety and Applied Nutrition.
March 29, 2001
24. FAO/IAEA. Final FAO/IAEA research coordination meeting on the use of irradiation to control infectivity of
foodborne parasites. Food Irradiation Newsletter. 1992;
16(1):5–14.
25. Food and Agricuture Organization (FAO). El estado mundial de la pesca y la acuicultura 2020. La sostenibilidad
en acción. 2020.
26. Fujita, T.; Waga, E.; Kitaoka, K.; et al. Human infection by
acanthocephalan parasites belonging to the genus Corynosoma found from small bowel endoscopy. Parasitol
Int, 2016; 65(5), 491-493.
27. Gago Cabezas, L.; Iglesias, E. G.; Nuevo, J. F.; Izquierdo, J. G. Informe de Vigilancia Tecnológica: Métodos para la detección
e inactivación de Anisakis simplex y patologıas que produce.
Informe realizado para la asociación ADEPESCA, 56. 2007.
28. Gajadhar, A. A. (Ed.). Foodborne parasites in the food supply
web: occurrence and control. Woodhead Publishing. 2015.
29. Gardiner, M. A. Survival of Anisakis in cold smoked salmon. Food Res Int, 1990; 23(2-3), 143-144.
30. Hauck, A. K. Occurrence and survival of the larval nematode Anisakis sp. in the flesh of fresh, frozen, brined, and smoked pacific
herring, Clupea harengus pallasi. J Parasitol, 1977; 515-519.
31. Hilliard, D. K. The effects of low temperatures on larval
cestodes and other helminths in fish. J Parasitol, 1959;
45(3), 291-294.
32. Hochberg, N. S.; Hamer, D. H.; Hughes, J. M.; Wilson, M.
E. Anisakidosis: perils of the deep. Clin Infect Dis, 2010;
51(7), 806-812.
33. Hurst, R. J. Identification and description of larval Anisakis simplex and Pseudoterranova decipiens (Anisakidae:
Nematoda) from New Zealand waters. N Z J Mar Freshwater Res, 1984; 18(2), 177-186.
34. Irigoitia, M. M.; Palomba, M.; Braicovich, P. E.; et al. Genetic identification of Anisakis spp. (Nematoda: Anisakidae)
from cetaceans of the Southwestern Atlantic Ocean: ecological and zoogeographical implications. Parasitol Res,
2021; 120(5), 1699-1711.
35. Kaito, S.; Sasaki, M.; Goto, K.; et al. A case of small bowel
obstruction due to infection with Bolbosoma sp.(Acanthocephala: Polymorphidae). Parasitol Int, 2019; 68(1), 14-16.
36. Karel, M.; Lund, D. B. Physical principles of food preservation: revised and expanded. CRC Press. 2003.
37. Karl, H.; Roepstorff, A.; Huss, H. H.; Bloemsma, B. Survival of Anisakis larvae in marinated herring fillets. Int
J Food Sci Technol, 1994; 29(6), 661-670.
38. Karpiej, K.; Dzido, J.; Rokicki, J.; Kijewska, A. Anisakid nematodes of Greenland halibut Reinhardtius hippoglossoides
from the Barents Sea. J Parasitol, 2013; 99(4), 650-654.
39. Køie, M., Berland, B., Burt, M. D. Development to thirdstage larvae occurs in the eggs of Anisakis simplex and
Pseudotetranova decipiens (Nematoda, Ascaridoidea, Anisakidae). Can J Fish Aquat Sci, 1995; 52(S1), 134-139.
40. Køie, M.; Fagerholm, H. P. The life cycle of Contracaecum
osculatum (Rudolphi, 1802) sensu stricto (Nematoda,
Ascaridoidea, Anisakidae) in view of experimental infections. Parasitol Res, 1995; 81(6), 481-489.
41. Lanfranchi, A. L.; Sardella, N. H. Anisakids survival after
microwaving, freezing and salting fish from Argentina.
Food Sci Technol Res, 2010; 16(5), 499-504.
42. Marty, A.M.; Neafie, R.C. Diphyllobothriasis and sparaganosis. In: Meyers, W.M., Neafie, R.C., Marty, A.M., Wear, D.J.,
eds. Pathology of Infectious Diseases. Vol. 1. Helminthiases. Armed Forces Inst Pathol. 2000; 165–183.
43. Mattiucci, S.; Nascetti, G. Advances and trends in the molecular systematics of anisakid nematodes, with implications
for their evolutionary ecology and host—parasite co-evolutionary processes. Adv Parasitol, 2008; 66, 47-148.
44. Mattiucci, S.; Paoletti, M.; Webb, S. C.; et al. Genetic relationships among species of Contracaecum Railliet &
Henry, 1912 and Phocascaris Höst, 1932 (Nematoda:
Anisakidae) from pinnipeds inferred from mitochondrial
cox2 sequences, and congruence with allozyme data. Syst
Parasitol, 2008; 54, 13–23.
45. Nawa, Y.; Hatz, C.; Blum, J. Sushi delights and parasites:
the risk of fishborne and foodborne parasitic zoonoses in
Asia. Clin Infect Dis, 2005; 41(9), 1297-1303.
46. Nadler, S. A.; D’Amelio, S.; Dailey, M. D.; Paggi, L.; Siu, S.;
Sakanari, J. A. Molecular phylogenetics and diagnosis of Anisakis, Pseudoterranova, and Contracaecum from northern
Pacific marine mammals. J Parasitol, 2005; 91(6), 1413-1429.
47. Oh, S. R.; Zhang, C. Y.; Kim, T. I., et al. Inactivation of Anisakis larvae in salt-fermented squid and pollock tripe by
freezing, salting, and combined treatment with chlorine
and ultrasound. Food control, 2014; 40, 46-49.
48. Omidzahir, S.; Shirazi, A. S.; Hosseini, S. M. Morphological
and molecular identification of Corynosoma caspicum, and
its histopathological effect on the intestinal tissue of a Caspian seal (Pusa caspica). Iran J Vet Res, 2020; 21(4), 308.
49. Peduzzi, R; Boucher-Rodoni, R. Resurgence of human
bothriocephalosis (Diphyllobothrium latum) in the subalpine lake region. J Limnol, 2001; 60(1), 41-44.
50. Podolska, M.; Pawlikowski, B.; Nadolna-Ałtyn, K.; Pawlak, J.; Komar-Szymczak, K.; Szostakowska, B. How effective is freezing
at killing Anisakis simplex, Pseudoterranova krabbei, and P. decipiens larvae? An experimental evaluation of time-temperature
conditions., Parasitol Res, 2019; 118(7), 2139-2147.
51. Pozio, E. Integrating animal health surveillance and food safety: the example of Anisakis. Rev Sci Tech, 2013; 32(2), 487-96.
52. Rahman, M. S.; Velez-Ruiz, J. F. Food preservation by freezing. En Handbook of food preservation, 2007 (pp. 653-
684). CRC Press.
53. Robertson, L. J. Parasites in food: from a neglected position
to an emerging issue. Adv Food Nutr Res, 2018; 86, 71-113.
54. Rodrigues, M. V.; de Perez, A. C. A.; Machado, T. M.; Orisaka, F. M.; Kurissio, J. K.; Lafisca, A. Research of Ascocotyle
(Phagicola) longa in heat treated fillets of mullet (Mugil
platanus). Fish aquac j, 2015; 6(1), 1.
55. Roth, D.; Arbetman, M.; Flores, V.; Semenas, L.; Viozzi, G.
Diphyllobothriidea in the north area of the Andean Patagonia: Epidemiology in urban dogs, morphometrical and
molecular identification, with comments on wild carnivores. Vet Parasitol Reg Stud Reports 2018; 14, 161-169.
56. Salminen, K. The Infestiveness of Heat and Gold Exposed
Diphyllobothrium Latum Plerocercoids on Golden Hamster. Acta Vet Scand, 1970; 11(2), 247-253.
57. Sánchez-Alonso, I.; Carballeda-Sangiao, N.; GonzálezMuñoz, M.; Arcos, S. C.; Navas, A.; Careche, M. Thermal
patterns of heat treated Anisakis L3-infected fishery
products allow separation into low, intermediate and
high risk groups of potential use in risk management.
Food Control, 2021; 124, 107837.
58. Sánchez-Monsalvez, I.; De Armas-Serra, C.; Martínez, J.; Dorado,
M.; Sánchez, A.; Rodríguez-Caabeiro, F. A New Procedure for Marinating Fresh Anchovies and Ensuring the rapid destruction of
Anisakis Larvae. J Food Prot. 2005; 68 (5). pp: 1066-1072.
59. Santos, C. P.; Borges, J. N. Current Knowledge of Small
Flukes (Digenea: Heterophyidae) from South America.
Korean J Parasitol, 2020; 58(4), 373.
60. Sasaki, M.; Katahira, H.; Kobayashi, M.; Kuramochi, T.;
Matsubara, H.; Nakao, M. Infection status of commercial
fish with cystacanth larvae of the genus Corynosoma
(Acanthocephala: Polymorphidae) in Hokkaido, Japan. Int
Journal Food Microbiol, 2019; 305, 108256.
61. Scholz, T.; Kuchta, R.; Brabec, J. Broad tapeworms (Diphyllobothriidae), parasites of wildlife and humans: recent progress and future challenges. Int J Parasitol Parasites Wildl, 2019; 9, 359-369.
62. Seo, M.; Kho, B.M.; Guk, S.M.; Lee, S.H.; Chai, J.Y. Radioresistance of Anisakis simplex third-stage larvae and the possible
role of superoxide dismutase. J Parasitol, 2006; 92, 416-418.
63. Shamsi, S.; Gasser, R.; Beveridge, I. Genetic characterisation and taxonomy of species of Anisakis (Nematoda:
Anisakidae) parasitic in Australian marine mammals. Invertebr Syst, 2012; 26(2), 204-212.
64. Smaldone, G.; Marrone, R.; Palma, G.; Sarnelli, P.; Anastasio, A. Preliminary study on the inactivation of anisakid
larvae in baccalà prepared according to traditional methods. Ital J Food Saf, 2017; 6(4).
65. Titova, S. D. Survival of plerocercoids of Diphyllobothrium
latum in the presence of low temperatures and salt. Med
Parazitol (Mosk), 1955; 24(3), 255-256.
66. Topuz, O. K.; Gökoğlu, N. Anisakiasis: parasitic hazard in raw
or uncooked seafood products and prevention ways. Food
and Health, 2017; 3(1), 21-28
67. Van Mameren J.; Houwing H. Effect of irradiation on Anasakis larvae in salted herring. In Elimination of harmful
organisms from food and feed by irradiation. At Energy Rev, Vienna, 1968; 73–80.
68. Vidaček, S.; De Las Heras, C.; Solas, M. T.; García, M. L.; Mendizabal, A.; Tejada, M. Viability and antigenicity of Anisakis
simplex after conventional and microwave heating at fixed
temperatures. J Food Prot, 2011; 74(12), 2119-2126.
69. Waeschenbach, A.; Brabec, J.; Scholz, T.; Littlewood, D.
T. J.; Kuchta, R. The catholic taste of broad tapeworms–
multiple routes to human infection. Int J Parasitol, 2017;
47(13), 831-843.
70. World Health Organization (WHO). Multicriteria-based
ranking for risk management of food-borne parasites: report of a Joint FAO. FAO, World Health Organization. 2014.
71. Wharton, D. A.; Aalders, O. The response of Anisakis larvae to freezing. J Helminthol, 2002; 76(4), 363-368.