REVISIÓN BIBLIOGRÁFICA
Biomarcadores moleculares en mastitis bovina
Caggiano, N1; De Simone, E1.
1
Universidad de Buenos Aires. Facultad de Ciencias Veterinarias. Cátedra de Fisiología Animal
Recibido:15/07/2021
Aceptado:14/02/2022
Correspondencia e-mail:Emilio De Simone edesimone@fvet.uba.ar
Resumen
La mastitis es la inflamación de la glándula mamaria, generalmente derivada de una infección microbiana. Es la patología con mayor morbilidad y mortalidad dentro de los rodeos lecheros, afectando la
producción láctea y la rentabilidad de los tambos. Además, si el proceso es muy grave o perdura en el
tiempo genera daños muchas veces irreversibles en la glándula mamaria. Es por eso que, además del recuento de células somáticas, y el análisis del perfil proteico, la evaluación de marcadores moleculares relacionados con la inflamación resulta de interés para el diagnóstico temprano, control y pronóstico de la
enfermedad. Marcadores moleculares como las metaloproteasas (MMPs), lactato deshidrogenasa (LDH),
N-Acetil-β-D-Glucosaminidasa (NAGasa), Beta glucuronidasa y los glicosaminoglicanos (GAGs) también
se encuentran relacionados con la enfermedad mamaria. Algunos biomarcadores involucran proteasas
que degradan la matriz extracelular como pueden ser las metaloproteasas 2 y 9 entre otras. Estas proteasas fisiológicamente están encargadas del normal remodelado de la matriz extracelular. Sin embargo, las
proteasas juegan un rol preponderante en la fisiopatología de los procesos mastíticos, especialmente en
su presentación recidivante, siendo la inhibición de las MMPs una propuesta terapéutica interesante. Las
enzimas LDH, NAGasa y beta glucuronidasa son indicadores de inflamación dado que el incremento de su
actividad se asocia con gránulos de lisosomales de leucocitos. Los GAGs son constituyentes de la matriz
extracelular y podrían utilizarse como indicadores de sanidad mamaria, porque se mantienen constantes
en leche a lo largo del proceso productivo de los animales sanos y se elevan ante procesos patológicos leves. El análisis y seguimiento de marcadores en vacas lecheras podrían ser un complemento importante
de las pruebas convencionales para el diagnóstico y seguimiento de la sanidad de la glándula mamaria.
Palabras clave:mastitis, biomarcadores, diagnóstico, MMPs, GAGs
Molecular biomarkers in bovine mastitis
Summary
Mastitis is an inflammation of the mammary gland generally caused by a bacterial infection. It is the
disease that has the highest morbidity and mortality within dairy herds, affecting milk production and the
profitability of the dairy farms. Besides, if the process is severe or prolonged, it often causes irreversible
damage to the mammary gland. In addition to the somatic cell count and profile protein analysis, the
evaluation of molecular markers related to inflammation is of interest for the early diagnosis, control and
prognosis of the disease. Molecular markers such as metalloproteinases (MMPs), lactate dehydrogenase
(LDH), N-Acetyl-β-D-Glucosaminidase (NAGase), Beta glucuronidase, and glycosaminoglycans (GAGs) are
also related to udder disease. Some biomarkers involve proteases that degrade the extracellular matrix, such
as metalloproteinases 2 and 9, among others. These proteases are physiologically responsible for the normal
remodeling of the extracellular matrix. However, proteases play a preponderant role in the pathophysiology
of mastitic processes, especially in their recurrent presentation, with the inhibition of MMPs being an
interesting therapeutic proposal. The enzymes LDH, NAGase and beta glucuronidase are indicators of
inflammation, since the increase in their activity is associated with leukocyte lysosomal granules. GAGs
are constituents of the extracellular matrix and could be used as indicators of mammary health, because
they remain constant in milk throughout the productive process of healthy animals and rise in light of
mild pathological processes. The analysis and monitoring of markers in dairy cattle could be an important
complement to conventional tests for the diagnosis and monitoring of the health of the mammary gland.
Key words:mastitis, biomarkers, diagnosis, MMPs, GAGs
INTRODUCCIÓN
La mastitis es la inflamación de la glándula mamaria, generalmente derivada inicialmente
de una infección microbiana. Es la enfermedad
con mayor morbilidad y mortalidad dentro de los
rodeos lecheros, afectando seriamente a la producción láctea24.
Las mastitis pueden ser clasificadas de
diversas maneras y su clasificación nos facilita
el diagnóstico y tratamiento. Según el punto de
vista clínico las mismas pueden clasificarse en: a.
clínicas, que son fácilmente diagnosticables a través de la revisación de la glándula mamaria y de
las modificaciones macroscópicas de la secreción
láctea y b. subclínicas que sólo pueden ser determinadas a través del Conteo de Células Somáticas (CCS). En el primer caso, las mastitis clínicas
se pueden clasificar en distintos grados según
la intensidad en que se presenta la enfermedad:
grado 1 cuando se ve afectada solo la secreción
láctea, grado 2 si se ve afectada la secreción láctea y la glándula mamaria y grado 3 cuando se ve
afectada la secreción láctea, la glándula mamaria
y además hay signos sistémicos54.
En Estados Unidos, país con altos
estándares productivos, 99.7 % de los
establecimientos, reportaron al menos un caso
de mastitis. Asimismo 24,8 % de las vacas
presentaron mastitis clínica68. En Países Bajos el
porcentaje de vacas que padecen mastitis clínicas
es similar siendo del 28,1 %39. En Argentina,
distintos trabajos indicaron una prevalencia
mucho menor de mastitis clínicas en tambos de la
provincia de Córdoba de 2.5 %61 y 6,7 %69. Mientras
que la incidencia de mastitis subclínica informada en
tambos de nuestro país fue de 53.9%17. Autores de
distintos lugares del mundo reportaron incidencias
de mastitis subclínicas entre un 20 a 50 % en rodeos
lecheros de explotaciones intensivas y extensivas 1,58,6.
Los principales agentes etiológicos responsables, tanto de las mastitis clínicas como de
las subclínicas, son los géneros Staphylococcus y
Streptococcus, tomando mayor relevancia a nivel
mundial Staphylococcusz aureus (S. aureus)62. La
prevalencia de organismos patógenos descripta
por Neder y colaboradores en tambos de Argentina fue: S. aureus (42.60 %), Streptococcus uberis(Str. uberis) (27.10 %), Streptococcus dysgalactiae
(Str. dysgalactiae) (10.90 %) y Streptococcus agalactiae (Str. agalactiae) (4,70 %)50.
Las consecuencias económicas sobre el
manejo del rodeo de esta enfermedad son muy
importantes ya que la misma disminuye la producción láctea de los animales afectados, reduce la
ingesta alimentaria, aumenta la cantidad de leche
que se descarta por mala calidad, incrementa los
costos veterinarios y genera el rechazo prematuro de animales del tambo67. Otra serie de estudios
también asocian la mastitis con una disminución
en la pérdida de eficiencia reproductiva en general65. Por otra parte, la mastitis provoca la merma de la calidad de los productos derivados de
la leche siendo su prevención, diagnóstico y tratamiento un gran desafío para el profesional veterinario, especialmente en aquellos casos en que la
enfermedad recidiva en forma insistente. Además,
el uso repetitivo de antibióticos en la producción
de bovinos debido a esta enfermedad contribuye
al desarrollo de resistencia en especies microbianas causantes de mastitis42.
Esta situación conlleva a grandes pérdidas económicas ya que el costo de tener un animal con mastitis subclínica se eleva en un 70 %,
no solo debido a su menor producción láctea sino
también por el daño asociado del tejido glandular,
que en algunos casos es irreversible, aún después
del tratamiento, y lleva al descarte temprano del
animal53. Anualmente a nivel mundial se pierden
más de 500.000 millones de dólares a causa de
las mastitis subclínicas 55,18. El diagnóstico de las
mastitis subclínicas es variado e incluye métodos
al pie de la vaca como el Test Mastitis California
(TMC) y de conductividad eléctrica o métodos
como el conteo de células somáticas (CCS) a través
de contadores de células automáticos64,33,3.
A continuación, describiremos el método
más utilizado a campo que es TMC que se fundamenta en la detección del incremento de las células somáticas y posteriormente desarrollaremos
biomarcadores utilizados y en desarrollo para el
diagnóstico de mastitis.
Test de Mastitis California y Conteo de Células
Somáticas
Como se mencionó anteriormente las células somáticas en la leche disminuyen la calidad
de esta. El conteo de células somáticas es un método indirecto de diagnóstico para las mastitis subclínicas, dado que el aumento de células somáticas
se correlaciona directamente con la inflamación
de la glándula mamaria.
Una forma práctica y rápida de estimar
de forma semicuantitativa las células somáticas es
mediante el Test de Mastitis California. Esta prueba consiste en disrumpir las membranas celulares
permitiendo que el ADN de las células interactúe
con el reactivo produciendo una gelificación que
puede ser visualizada macroscópicamente.
EL CCS ya sea analizado de forma indirecta mediante el TMC o directa mediante citometría
es una importante herramienta para el monitoreo
de la sanidad de la glándula mamaria10. Se considera que las vacas presentan mastitis subclínica
cuando el recuento de las células somáticas en
leche es mayor de 1 o 2 × 105
células/ml38. Fisiológicamente, los leucocitos polimorfonucleares
aumentan tras el destete y en la involución temprana, sin embargo, más tardíamente las células
que aumentan son los macrófagos.
Una correcta rutina de ordeñe, junto con
pautas de control y monitoreo de los niveles de
células somáticas, son cruciales para mantener
la salubridad mamaria. Existen algunos estudios
que plantean la administración de melatonina
exógena por vía subcutánea para reducir el recuento de células somáticas en la leche, mejorando
la actividad inmune de las vacas e incrementando sus niveles de IgG e IgM.71.
Perfil de proteínas
El perfil de proteínas en leche puede ser
analizado mediante SDS-PAGE (Figura 1). Durante
el transcurso de los procesos de mastitis la integridad de la barrera hemato-láctea se ve afectada
permitiendo el pasaje de proteínas séricas hacia la
leche. Estas proteínas en los análisis electroforéticos se las refiere como proteínas de alto peso molecular para diferenciar de las proteínas lácteas
como la caseína (fracciones alfa, beta y kappa),
lactoalbúmina y lactoglobulina que poseen menos
de 30kDa. La presencia de componentes séricos
en la secreción láctea, así como la disminución de
la caseína, está asociada a una menor calidad de la
leche. En trabajos previos hemos observado que la
proteína total en los procesos mastíticos no se ve
significativamente afectada, sin embargo mediante
el análisis densitométrico por SDS-PAGE hemos ob-servado un aumento considerable de las proteínas
de alto peso molecular y una caída importante de
caseína principalmente la fracción kappa caseína,
una de las más valoradas en la industria quesera9.
Las proteínas que se encuentran clasificadas como
de alto peso molecular incluyen a la lactoferrina,
lactoperoxidasa, inmunoglobulina y albúmina sérica. Estas proteínas se encontrarían incrementadas
en la leche debido al aumento de la permeabilidad
vascular como consecuencia de los procesos inflamatorios49,63. En animales con mastitis la kappa
caseína se encuentra disminuida principalmente
debido a la acción de proteasas que se encuentran
incrementada en estos tipos de procesos25.
S. aureus es un patógeno que secreta proteasas capaces de degradar las caseínas. Además, en
bovinos, los cuartos afectados por S. aureus tienen un
área alveolar más pequeña y un área estromal más
grande en comparación con los cuartos sanos. Siendo
que la sección infectada tiene una capacidad de
síntesis reducida. Esta observación podría aplicarse
a otras especies de rumiantes productores de leche45.
Asimismo, durante los procesos inflamatorios, las enzimas implicadas en el proceso
de síntesis de proteínas de la leche tienen una
actividad menor59.
Por otro lado, se ha visto que la cantidad
de kappa caseína puede variar de un animal a
otro. Esto responde a variaciones genéticas como
han descripto Medrano y Aguilar-Córdova en vacas Holstein donde el alelo B de la kappa caseína
está relacionado a un mayor rendimiento y calidad de esta proteína47.
Metaloproteasas (MMPs)
Las metaloproteasas de matriz 2 y 9
(MMP-2 y MMP-9 respectivamente) son endopeptidasas dependientes de zinc que desempeñan un
papel crucial en la degradación de la matriz extracelular, la inflamación y la remodelación tisular.
Participando en procesos fisiológicos y patológicos.
En los últimos años se ha visto que estas proteasas
juegan un rol muy importante en la progresión de
procesos tumorales y su actividad puede ser inhibida por quelantes de zinc57,70. Todos los genes de las
MMPs presentan una estructura modular altamente conservada5
. Entre algunos procesos fisiológicos
en los que participan las MMPs están el desarrollo
embrionario, los procesos de remodelación y envejecimiento19. La principal fuente de MMPs son los
leucocitos circulantes. Es por ello que las MMPs
cumplen un rol central en el proceso de daño tisular como consecuencia de las mastitis.
Trabajos previos indican que las células somáticas en la leche secretada por vacas que
sufren de mastitis presentan una alta actividad de
MMPs7,9,2. Li y colaboradores mostraron una correlación positiva entre el recuento de células somáticas en leche y la MMP-9, siendo además que
la infección por S. aureus incrementaba de manera notoria la expresión de MMP-9 por las células
epiteliales de los ductos mamarios43. También, el
incremento de la expresión de MMP-9 es un importante marcador de la infección mamaria por
E. coli44. A su vez, se ha demostrado que las MMPs
2 y 9 degradan la membrana basal y las proteínas.
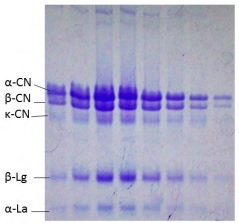
Figura 1.Perfil de proteínas de la leche analizado mediante SDS-PAGE 15%. En la calle 1 se observa la muestra control de leche bovina donde se indican las proteínas presentes: α-caseína (α-CN), β- caseína (β-CN), κ- caseína (κ-CN),
β-lactoglobulina (β-Lg) y α-lactoalbúmina (β-Lg). Calles 2-8 diferentes muestras de leche bovina.
intersticiales, y se encuentran incrementadas hasta 300 veces en la leche de vaca con mastitis colibacilar en comparación con la leche de animales
sanos45. Igualmente, se observó incrementos de la
actividad de la MMP-2 y MMP-9 en tejido mamario
y secreciones en cuartos mamarios de vacas infectadas crónicamente con S. aureus, en comparación
con sus cuartos sanos4
. Además, se observó que los
fibroblastos tratados con S. aureusz inactivado mostraron un incremento en la actividad de la MMP-248.
La activación de MMPs perdura incluso
después de resuelto el proceso infeccioso-inflamatorio. Estas metaloproteasas y el daño tisular
que producen podrían ser la causa incluso de
mastitis en las cuales el TMC da positivo, aunque
los cultivos den negativos. La posibilidad de generar y probar sustancias inhibidoras de las MMPs
en coincidencia con las mastitis no solo podrían
favorecer la resolución de mastitis, sino que también podrían reducir el uso de antibióticos favoreciendo un uso más prudente de los mismos lo
que disminuiría la resistencia a los mismos. Sin
embargo, Gifre-Renom y colaboradores indicaron que la infusión en la glándula mamaria de
cuerpos de inclusión de MMP-9 como nanopartículas al momento del secado favorecería la involución y la función inmune de la glándula mamaria como consecuencia de la acción fisiológica de
esta proteasa durante el secado23.
Las MMPs 2 y 9 presentan en su forma
activa un peso molecular de 72 y 92 kDa respectivamente. Una forma de analizar la actividad de las
MMPs es mediante Zimografía en SDS-PAGE con el
agregado de gelatina (Figura 2).
La activación de MMPs se puede dar por
múltiples mecanismos entre los que están involucrados el potencial redox intracelular y la presencia de diversas citoquinas20. Además, la actividad
de las MMPs está regulada por los inhibidores tisulares de metaloproteasas (TIMPs) presentes en
los tejidos11. Los TIMPs regularían amortiguando
la actividad de las MMPs.
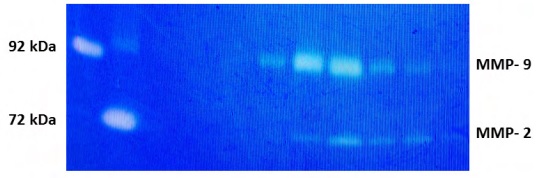
Figura 2.Análisis de la actividad de las MMPs mediante Zimografía en SDS-PAGE 10% con el agregado de 0.2% de
gelatina. De izquierda a derecha calle 1 control MMP-9, calle 2 control MMP-2 y calles 2-8 corresponde a diferentes
muestras de leche bovina.
N-Acetyl-β-D-Glucosaminidase (NAGasa)
Esta enzima se encuentra presente en los
gránulos lisosomales de los leucocitos polimorfonucleares pudiendo también ser liberada además
cuando hay daño de las células epiteliales de la
glándula mamaria, por lo que su incremento acompaña los procesos inflamatorios de la glándula mamaria59. La NGAasa está asociada con lisis celular y
daño tisular29. Además, presenta un efecto bactericida favoreciendo la reducción bacteriana30.
La NAGasa es un importante biomarcador
de mastitis bovina y se correlaciona muy bien con
el recuento de células somáticas60. La técnica de
determinación de la actividad de esta enzima fue
descripta por primera vez por Kitchen y colaboradores en 198437.
Lactato Deshidrogenasa (LDH)
La LDH es una enzima ubicua que está
presente en el citoplasma de todas las células ytejidos del organismo. Esta enzima puede considerarse un indicador confiable de la intensidad
del proceso inflamatorio en la glándula mamaria,
especialmente en el caso de mastitis subclínica.
Este biomarcador puede resultar muy útil para
los sistemas automatizados de control de mastitis. Por este motivo la cuantificación de LDH puede monitorear la sanidad de glándula mamaria ya
que sus valores se incrementan durante procesos
infecciosos28. Asimismo, la presencia de LDH en
leche también estaría indicando una disrupción
de la barrera hemato-lechera producida por la
mastitis41. Se notificó que las infecciones por
ciertas bacterias produjeron mayores incrementos, siendo que E. coli y Str. uberis mostraron los
mayores incrementos27. Otro autor describió mayores incrementos en infecciones por bacterias
Gram negativas36. Además, la LDH muestra una
mayor sensibilidad que la NAGasa para identificar
mastitis subclínicas12.
Beta glucuronidasa (β-glucuronidasa)
La β-glucuronidasa es otra enzima lisosomal que también es un marcador relevante que se
incrementa en procesos inflamatorios de la glándula mamaria52. Sin embargo, la poca actividad de
la misma le quitaría importancia respecto a otros
biomarcadores40.
Glicosaminoglicanos (GAGs)
Los GAGs son moléculas que se encuentran principalmente en el tejido conectivo de diversos tejidos, entre ellos la glándula mamaria.
Es por ello que los GAGs pueden llegar a ser una
alternativa interesante para evaluar in situ la sanidad de los animales en producción.
Los GAGs son cadenas de polisacáridos
largas no ramificadas22. La presencia de grupos
carboxilos y sulfatos le dan a los GAGs la propiedad de ser muy hidrofílicos. Esta propiedad hace
que puedan estar en forma de gel y ocupar grandes espacios de la matriz extracelular dando sostén a distintos tejidos32. La mayoría de los GAGs
se encuentran covalentemente unidos a proteínas
formando proteoglicanos26. Dentro de los GAGs, el
más importante en la glándula mamaria es el ácido hialurónico, este GAG cumple funciones en la
embriogénesis, morfogénesis, reparación tisular e
inflamación de este órgano35. Otro GAG de importancia en la glándula mamaria es el versican, éste
es un modulador del comportamiento celular, el
cual en relación a distintos factores de crecimiento puede controlar la acción de células madre en
el tejido mamario46. Más allá de estar presentes en
los tejidos previamente citados, se pueden encontrar GAGs en la leche donde principalmente cumplen funciones en relación con la inmunidad de la
glándula mamaria51.
Cuando comparamos los niveles de GAGs
en leche de animales sanos, con mastitis subclínica y con mastitis clínica pudimos observar que los
animales sanos son los que menos niveles de GAGs
contienen, mientras que los animales afectados
subclínicamente tienen un nivel intermedio y los
animales con signología clínica tienen los mayores
niveles8
. Si bien entre los distintos grados de mastitis no se encontraron diferencias significativas,
si hubo diferencias con respecto a los individuos
sanos. Esto puede ser explicado en parte debido a
que proteasas como las metaloproteasas 2 y 9 se
ven aumentadas durante las mastitis9
. Por lo tanto
la degradación de la matriz extracelular permitiría
la liberación hacia la secreción láctea de los GAGs
presentes en la misma.
El aumento de los GAGs ante procesos infecciosos fue descripto en varias enfermedades.
Por ejemplo, se ven aumentados los niveles de
ciertos GAGs, como el ácido hialurónico o el versican, ante afecciones respiratorias inducidas por
E. coli en ratones13. Por otro lado, bacterias como
S. aureus y Streptococcus pneumoniae pueden degradar GAGs de sus cores proteicos, tanto por proteasas propias como del hospedador, dejándolos
libres aumentando su concentración en los fluidos
corporales14,56. Además, algunas bacterias de los
géneros Streptococcus, Escherichia y Pasteurella
pueden sintetizar GAGs similares a los encontrados en mamíferos como parte constitutiva de su
cápsula16,15. Esto hace razonable que ante procesos infecciosos en la glándula mamaria los GAGs
se vean aumentados. Pero más allá de verse aumentados en este tipo de proceso, también se ven
aumentadas estas moléculas en tejidos que están
bajo un proceso inflamatorio31. Con lo cual el aumento de los GAGs en animales con cultivos bacteriológicos negativos podría ser explicado por lo
previamente dicho o porque el agente etiológico
infeccioso no fue diagnosticado.
Con respecto a los resultados observados
en relación al TMC y los GAGs, resulta interesante que éstos últimos se vean aumentados en los animales con mastitis subclínica de grado I, ya que es
el grado donde se observa menor especificidad del
TMC, siendo que ya de por sí la sensibilidad de la
técnica es deficiente34,21.
Esto hace que la determinación de los
GAGs podría sumarse como una herramienta para
la toma de decisiones en los establecimientos ya
que podríamos tener una prognosis sobre la performance productiva de un animal, similar al uso
que se le da en medicina humana en relación a distintas neoplasias66. Por lo tanto, este tipo de moléculas, evaluadas en su totalidad, serían indicadores
del estado de sanidad, ya que ante leves variaciones
nos indican la presencia de procesos mastitícos8
.
CONCLUSIONES
A lo largo de este trabajo hablamos del impacto económico de la mastitis bovina en los rodeos
lecheros y la importancia de su rápido diagnóstico
para disminuir dicho impacto. Para ello necesitamos
de técnicas que sean fiables y fáciles de implementar en condiciones a campo. Es por ello que requerimos la optimización de las pruebas con las que
ya contamos, como el TMC o el CCS, tanto como la
adaptación de pruebas que se desarrollan a nivel
laboratorio como la determinación de MMPs, perfiles proteicos o GAGs. Un ejemplo de ello es lo que
sucede con la LDH que está siendo incorporada en
sistemas robotizados y que se combina con otras
determinaciones como el CCS en línea. Esto nos da
la pauta de que los sistemas de diagnósticos del
futuro tendrán un abanico de técnicas que permitirán una rápida y segura detección de animales con
procesos inflamatorios incipientes.
BIBLIOGRAFÍA
1. Alfonso, D.; Zanette, J.; Ruiz, K. et al. Situación de la mastitis subclínica y evaluación de los procesos lecheros en vaquerías de la provincia Villa Clara, Cuba. Revista de Salud
Animal. 2017; 39 (3), 00.
2. Barkema H.; Schukken Y.; Lam T. et al. Incidence of clinical
mastitis in dairy herds grouped in three categories by bulk
milk somatic cell counts. J Dairy Sci. 1998; 81(2):411–9. 10.
3. Barkema H.W.; Deluykerb H.A.; Schukkenc Y.H. et al. Quarter‐milk somatic cell count at calving and at the first six
milkings after calving. Prev Vet Med. 1999; 38: 1‐9.
4. Beccaria, C.; Velazquez, N.S.; Chervaz, V. et al. Involvement of matrix metalloproteinases and their inhibitors
in Staphylococcus aureus chronically infected bovine
mammary glands during active involution. Res Vet Sci 137
(2021) 30–39.
5. Birkedal-Hansen, H.; Moore, W. G. I.; Bodden, M. K. et al.
Matrix Metalloproteinases: A Review. Crit Rev Oral Biol
Med. 1993; 4(2): 197-250.
6. Busanello, M.; Rossi, R; Cassoli, L; et al. Estimation of
prevalence and incidence of subclinical mastitis in a large
population of Brazilian dairy herds. , J Dairy Sci. 2017;
100: 6545-6553.
7. Caggiano N.; Bottini J.M.; Lorenzo Smirnoff A. et al. Determinación de biomarcadores moleculares en leche y su
posible aplicación en el diagnóstico y tratamiento de la
mastitis bovina. InVet. 2016; 18 2.
8. Caggiano, N; De Simone, E. Niveles de glicosaminoglicanos
en leche como indicador de salubridad mamaria en vacas
Holstein. Jornadas de Jóvenes Investigadores AUGM (26º :
2018 : Mendoza, Argentina). Ponencia de trabajo premiado.
9. Caggiano, N.; Lorenzo Smirnoff, A.; Bottini, J.M. et al. Protease activity and protein profile in milk from healthy
dairy cows and cows with different types of mastitis.
Int Dairy J. 2019; 89:1-5.
10. Caraviello, D. Z.; Weigel, K. A.; Shook, G. E. et al. Assessment of the impact of somatic cell count on functional
longevity in Holstein and Jersey cattle using survival analysis methodology. J Dairy Sci. 2005; 2, 804–811.
11. Cascales, M.; Álvarez-Gómez J.A. Metaloproteinasas, matriz extracelular y cáncer. An R Acad Nac Farm. 2010; 76
(1): 59-84.
12. Chagunda, M.; Larsen, T.; Bjerring, M. et al. L-lactate dehydrogenase and N-acetyl-β-D-glucosaminidase activities
in bovine milk as indicators of non-specific mastitis. J
Dairy Res. 2006; 73(4), 431-440.
13. Chang, M.Y.; Tanino, Y.; Vidova, V. et al. A rapid increase
in macrophage-derived versican and hyaluronan in infectious lung disease. Matrix Biology. 2014; 34 1–12.
14. Chen, Y.; Bennett, A.; Hayashida, A. et al. Streptococcus pneumoniae sheds syndecan-1 ectodomains via ZmpC, a metalloproteinase virulence factor. J Biol Chem. 2007; 282:159–67.
15. Chung, J.Y.; Wilkie I, Boyce, J.D. et al. Role of capsule in
the pathogenesis of fowl cholera caused by Pasteurella
multocida serogroup A. Infect Immun. 2001; 69:2487–92.
16. . DeAngelis, P.L. Microbial glycosaminoglycan glycosyltransferases. Glycobiology. 2002; 12:9R–16R.
17. Dieser S. A.; Vissio C.; Lasagno M. C. et al. Prevalence of
Pathogens Causing Subclinical Mastitis in Argentinean
Dairy Herds Pak Vet J. 2014; 34(1): 124-126
18. . Edmondson P.W. and Bramley A.J. (2004) Mastitis. Chapter 23, 326-337. Bovine Medicine Diseases and Husbandry
of Cattle. Second edition. by Blackwell Science Ltd.
19. . Freitas-Rodríguez, S.; Folgueras, A.R.; López-Otín, C. The
role of matrix metalloproteinases in aging: Tissue remodeling and beyond. Biochim Biophys Acta Mol Cell Res. 2017;
1864 11 Part A.
20. Fontani F.; Domazetovic V.; Marcucci T. et al. MMPs, ADAMs and Their Natural Inhibitors in Inflammatory Bowel
Disease: Involvement of Oxidative Stress. J Clin Gastroenterol Treat. 2017; 3:039.
21. Fosgate, G.T.; Petzer, I.M.; Karzis, J. Sensitivity and specificity of a hand-held milk electrical conductivity meter
compared to the California mastitis test for mastitis in
dairy cattle. The Veterinary Journal. 2013; 196 98–102.
22. Gandhi N.S.; Mancera R.L. The structure of glycosaminoglycans and their interactions with proteins. Chem Biol
Drug Des. 2008; 72(6):455-82.
23. Gifre-Renom, L.; Carratalá, J.V.; Parés, S. et al. Potential of
MMP-9 based nanoparticles at optimizing the cow dry
period: pulling apart the effects of MMP-9 and nanoparticles. Sci Rep. 2020; 10, 11299.
24. Gröhn Y. T.; Eicker S. W.; Ducrocq V.; Hertl J. A. Effect of
Diseases on the Culling of Holstein Dairy Cows in New
York State. J Dairy Sci. 1998; 81:966–978.
25. Haddadi, K.; Prin-Mathieu, C.; Moussaoui, F. et al. Polymorphonuclear neutrophils and Escherichia coli proteases involved in proteolysis of casein during experimental
E. coli mastitis. Int Dairy J. 2006; 16, 639–647.
26. Häcker, U; Nybakken, K.; Perrimon, N. Heparan sulphate
proteoglycans: the sweet side of development, Nat. Rev.
Mol. Cell Biol. 2005; 6 530–541.
27. . Hernández-Castellano, L; Wall, S K; Roger, S. et al. Milk
somatic cell count, lactate dehydrogenase activity, and
immunoglobulin G concentration associated with mastitis
caused by different pathogens: a field study. Schweizer Archiv für Tierheilkunde. 2017; 159(5):283-290.
28. Hiss S.; Mueller U.; Neu-Zahren A. et al. Haptoglobin and
lactate dehydrogenase measurements in milk for the
identification of subclinically diseased udder quarters.
Vet. Med-Czech. 2007; 52: 245–252.
29. Hovinen, M.; Simojoki, H.; Suolaniemi, J. et al. N-acetyl-β-D-glucosaminidase activity in cow milk as an indicator of mastitis. J Dairy Sci. 2016; 83, 219–227.
30. Hussain, A.M.; Daniel, R.C.W.; Frost, A.J. The bactericidal
effect of N-acetyl-β-D-glucosaminidase on bacteria. Vet.
Microbiol. 1992; 32, 75–80.
31. Hussain, A.M.; Daniel, R.C.W.; Frost, A.J. The bactericidal
effect of N-acetyl-β-D-glucosaminidase on bacteria. Vet.
Microbiol. 1992; 32, 75–80.
32. Insua-Rodríguez, J.; Oskarsson, T. The extracellular matrix in breast cáncer. Advanced Drug Delivery Reviews.
2016; 97 41–55.
33. Janzekovic M.; Brus M.; Mursec B. et al. Mastitis detection based on electric conductivity of milk. Journal of
Achievements in Materials and Manufacturing Engineering. 2009; 34:1.
34. Kandeel, S.A.; Morin, D.E.; Calloway, C.D. et al. Association
of California Mastitis Test Scores with Intramammary
Infection Status in Lactating Dairy Cows Admitted to a
Veterinary Teaching Hospital. J Vet Intern Med. 2018;
32:497–505.
35. Karousou, E.; D’Angelo, M.L.; Kouvidi, K. et al. Collagen VI
and hyaluronan: the common role in breast cancer, BioMed.
Res. Int. 2014; 606458.
36. Khatun, M.; Bruckmaier, R.M.; Thomson, P.C. et al. Suitability of somatic cell count, electrical conductivity, and
lactate dehydrogenase activity in foremilk before versus
after alveolar milk ejection for mastitis detection. J Dairy
Sci. 2019; 102 10:9200-9212.
37. Kitchen, B. J.; Kwee, W.S.; Middleton, G. et al. Relationship
between the level of N-acetyl-β-D-glucosaminidase (NAGase) in bovine milk and the presence of mastitis pathogens. J Dairy Res. 1984; 51, 11–16.
38. Kivaria, F.M.; Noordhuizen, J.P.T.M.; Nielen, M. Interpretation of California mastitis test scores using Staphylococcus
aureus culture results for screening of subclinical mastitis
in low yielding smallholder dairy cows in the Dar es Salaam region of Tanzania. Prev Vet Med. 2007; 3, 274–285.
39. Lam, T.J.G.M.; Van Den Borne, B.H.P. J.; Jansen, K. Hogeveen Improving bovine udder health: A national control program in the Netherlands J. Dairy Sci. 2013; 96,
1301-1311.
40. Larsen, T.; Aulrich, K. Optimizing the fluorometric β-glucuronidase assay in ruminant milk for a more precise
determination of mastitis. J Dairy Res. 2012; 79(1), 7-15.
41. Lehmann M.; Wellnitz O.; Bruckmaier R. M. Concomitant
lipopolysaccharide-induced transfer of blood-derived
components including immunoglobulins into milk. J.
Dairy Sci. 2013; 96: 889–896.
42. Lhermie, G.; Verteramo C. L.; Kaniyamattam, K. et al. Antimicrobial Policies in United States Beef Production:
Choosing the Right Instruments to Reduce Antimicrobial
Use and Resistance Under Structural and Market Constraints. Front Vet Sci. 2019; 6 245.
43. Li H.; Zheng H.; Li L. et al. The Effects of Matrix Metalloproteinase-9 on Dairy Goat Mastitis and Cell Survival of Goat Mammary Epithelial Cells. PLoS ONE. 2016;
11(8): e0160989.
44. Li L.; Chen, X.; Chen, Z. Identification of Key Candidate Genes in Dairy Cow in Response to Escherichia
coli Mastitis by Bioinformatical Analysis. Front Genet.
2019; 10 1251.
45. McDougall, S.; Malcolm, D.; Prosser, C.G. Prevalence and
incidence of intramammary infections in lactating dairy
goats. N. Z. Vet. J. 2014; 62, 136–145.
46. McIntosh, J.; Dennison, G.; Holly, J.M. et al. IGFBP-3 can
either inhibit or enhance EGF-mediated growth of breast
epithelial cells dependent upon the presence of fibronectin. J Biol Chem. 2010; 285 38788–38800.
47. Medrano, J.F.; Aguilar-Córdova, E. Genotyping of Bovine
Kappa-Casein Loci Following DNA Sequence Amplification.
Biotechnology. 1990; 8: 144-146.
48. Miao, Z.; Ding, Y.; Bi, Y. et al. Staphylococcus aureus on the
effect of expression of MMPs/TIMPs and uPA system in
bovine mammary fibroblasts. J Microbiol Immunol Infect.
2021; 54 3: 411-419.
49. Mudaliar, M.; Tassi, R.; Thomas, F.C. et al. Mastitomics, the
integrated omics of bovine milk in an experimental model of Streptococcus uberis mastitis: 2. Label-free relative
quantitative proteomics. Mol Biosyst. 2016; 12, 2748-2761.
50. Neder, V. E.; Signorini, M. L.; Cuatrin, A. et al. Revista FAVE
- Ciencias Veterinarias. 2014; 13 (1-2).
51. Newburg, D.S. Glycobiology of Human Milk. Biochemistry
(Moscow). 2013; 78, 7: 771-785.
52. Oliszewski, R.; Núñez De Kairúz, M. S.; Gonzalez, S.N. et al.
Assessment of β-Glucuronidase Levels in Goat’s Milk as
an Indicator of Mastitis: Comparison with Other Mastitis
Detection Methods. J Food Prot. 2002; 65 (5): 864–866.
53. Oliver, S. P.; Calvinho, L. F. Influence of inflammation on mammary gland metabolism and milk composition. J. Anim.Sci.
1995; 73(Suppl. 2):18–33.
54. Oliveira L.; Hulland C.; Ruegg P. L. Characterization of clinical mastitis occurring in cows on 50 large dairy herds in
Wisconsin. J Dairy Sci. 2013; 96 12.
55. Ott, S. Costs of herd ‐ level production losses associated
with subclinical mastitis in US Dairy Cows. In Proceedings: 38th Annual meeting of National Mastitis Council,
1999 pp. 152 – 156. Arlington VA.
56. Park, P.W.; Foster, T.J.; Nishi, E. et al. Activation of syndecan-1 ectodomain shedding by Staphylococcus aureus
alpha-toxin and beta-toxin. J Biol Chem. 2004; 279:251–8.
57. Park, K.C.; Dharmasivam, M.; Richardson, D.R. The Role of
Extracellular Proteases in Tumor Progression and the Development of Innovative Metal Ion Chelators That Inhibit
Their Activity. Int. J. Mol. Sci. 2020; 21, 6805.
58. Pitkala, A.; Haveri, M.; Pyorala, S. et al. Bovine mastitis in
Finland 2001—Prevalence, distribution of bacteria, and
antimicrobial resistance. J Dairy Sci. 2004; 87:2433–2441.
59. Pyörälä, S. Indicators of inflammation in the diagnosis of
mastitis. Vet. Res. 2003; 34, 565–578.
60. Pyörälä, S.; Hovinen, M.; Simojoki, H. et al. Acute phase
proteins in milk in naturally acquired bovine mastitis
caused by different pathogens. Vet. Rec. 2011; 168:535.
61. Richardet, M.; Castro, S.; Tirante, L. et al. Magnitud y
variación de la mastitis clínica y sus costos asociados
en rodeos lecheros de Argentina. Arch Med Vet. 2016;
48, 153-158.
62. Ruegg P.L. Managing Mastitis and Producing Quality Milk.
Chapter 18, 207-233. Dairy production medicine. 2011.
John Wiley & Sons, Inc.
63. Ryman, V.; Packiriswamy, N.; Sordillo L.M. Role of endothelial cells in bovine mammary gland health and disease.
Anim Health Res Rev. 2015; 16, 135–149.
64. Schalm, O.W.; Noorlander, D.O. Experiments and observations leading to development of the California mastitis test.
J Am Vet Med Assoc. 1957; 130, 199-204.
65. Sharma N.; Shuaib, B.A.; Zul H.I., et al. Impact of mastitis
on reproductive performance in dairy animals: A review.
Theriogenology Insight. 2017; 7 1:41-49.
66. Shawky, M.S.; Ricciardelli, C.; Lord, M. et al. Proteoglycans:
Potential Agents in Mammographic Density and the Associated Breast Cancer Risk. J Mammary Gland Biol Neoplasia. 2015; 20:121–131.
67. USDA APHIS National Animal Health Monitoring System
2007. Dairy 2007: Part V: Changes in dairy cattle health
and management practices in the United States, 1996–
2007. USDA National Animal Health Monitoring Service.
Accessed Sep. 26, 2011.
68. USDA APHIS National Animal Health Monitoring System.
Dairy 2014 Milk Quality, Milking Procedures, and Mastitis
on U.S. Dairies, 2014.
69. Vissio, C.; Pereyra, M.; Lamberti, M. et al. Mastitis en vacas
Holstein y factores asociados en tambos de Córdoba, Argentina. Revista Veterinaria. 2021; 31(2):120.
70. Winkler, J.; Abisoye-Ogunniyan, A.; Metcalf, K.J. et al. Concepts of extracellular matrix remodelling in tumour progression and metastasis. Nat Commun. 2020; 11, 5120.
71. Yang, M.; Shi, J.; Tian, J. et al. Exogenous melatonin reduces somatic cell count of milk in Holstein cows. Sci
Rep. 2017; 7, 43280.

