ARTÍCULO DE INVESTIGACIÓN
Expresión del factor de crecimiento de endotelio vascular y de
ciclooxigenasa-2 en pacientes caninos con cáncer mamario
Pereira, Me1; Fidanza, Mm1; Artese, J1; Gonzalez, Sp1; Gabriele, C1
1
Universidad de Buenos Aires, Facultad de Ciencias Veterinarias, Cátedra de Patología Clínica y Enfermedades Médicas,
Chorroarín 280 (1427), Buenos Aires, Argentina.
Recibido: 15/07/2021
Aceptado: 25/11/2021
Correspondencia e-mail:Marcela Pereira mpereira@fvet.uba.ar
Resumen
Se trabajó con 17 muestras histopatológicas pertenecientes a pacientes caninos con neoplasias mamarias
malignas. Se evaluó por inmunohistoquímica la expresión del factor de crecimiento de endotelio vascular
(VEGF), la ciclooxigenasa-2 (COX-2), los receptores para estrógenos (RE) y progesterona (RP), la
sobreexpresión del proto-oncogén Herb2-Neu y el p53. El 47 % presentaron expresión positiva para el
VEGF, COX-2, Herb2-Neu y p53. Este grupo presentó diferencias significativas en relación al grupo con
expresión negativa, con una mediana de supervivencia de 175 y 850 días respectivamente. (p=0,009)
El 100 % presentaron expresión negativa para RE y RP. El 57 % de carcinomas simples y el 100 % de
carcinomas mixtos presentaron expresión positiva para el VEGF, COX-2, Herb2-Neu y p53, con compromiso
de linfonodos y metástasis. El 100 % de carcinomas anaplásicos presentaron expresión positiva para
el VEGF, Herb2-Neu y p53 y negativa para COX-2, con compromiso de linfonodos y metástasis. Si bien
el estudio de estos marcadores permite evaluar el riesgo de metástasis se requieren más estudios que
involucren un mayor número de pacientes que validen o no dichos hallazgos. El objetivo del presente
trabajo fue investigar la expresión del VEGF y de COX-2 para establecer su relación con otros marcadores
y para evaluar riesgo de metástasis en cáncer mamario canino.
Palabras clave: factor de crecimiento de endotelio vascular, ciclooxigenasa-2, cancer mamario
canino, inmunohistoquímica.
Vascular endothelial growth factor and cyclooxygenase-2
expression in canine patients with mammary cancer
Summary
It worked with 17 histopathological sections from canine patients with malignant mammary
neoplastic. It was evaluated by immunohistochemistry the vascular endothelial growth factor (VEGF),
cyclooxygenase-2 (COX-2) expression, estrogen (ER) and progesterone (PR) receptors, Herb2-Neu protooncogene overexpression and p53. The 47 % had positive expression for VEGF, COX-2, Herb2-Neu and
p53. This group presented significant differences in relation to the group with negative expression, with a
mean survival time of 175 and 850 days respectively. (p=0.009) The 100 % presented negative expression
for ER and PR. The 57 % of the simple carcinomas and 100 % of mixed carcinomas presented positive
expression for VEGF, COX-2, Herb2-Neu and p53, with lymph node involvement and metastases. The 100
% of the anaplastic carcinomas showed positive expression for VEGF, Herb2-Neu and p53 and negative
for COX-2, with lymph node involvement and metastases. Although markers study make it possible to
evaluate the risk of metastases, more studies involving a greater number of patients are required to
validate or not these findings. The work objective was to investigate the VEGF and COX-2 expression in
canine mammary cancer and its association to other marker and metastases risk.
Key words: vascular endothelial growth factor, cyclooxygenase-2, canine mammary cancer,
immunohistochemistry
INTRODUCCIÓN
La angiogénesis es un proceso esencial en
el tumor primario para crecer e invadir estructuras
adyacentes. El grado de densidad microvascular intratumoral refleja la actividad angiogénica
generada por las células neoplásicas y el estroma15. El aumento de la angiogénesis está
asociado a un diagnóstico desfavorable en enfermedades neoplásicas. El proceso está controlado
por factores angiogénicos y angioestáticos que influyen en la proliferación, diferenciación y organización de células endoteliales8,15.
La enzima ciclooxigenasa (COX), controla la síntesis de prostaglandinas (PGs) a partir del
ácido araquidónico. Se reconocen tres isoformas
de esta enzima COX-1, COX-2 y COX-314. Esta última
deriva del gen que codifica la COX-1 pero es estructural y funcionalmente diferente. Ambas, COX-1 y
COX-3, son constitutivas mientras que la COX-2 es
inducible14. Muchos tumores sobreexpresan COX-2,
mientras que esto no sucede en los tejidos normales
de los cuales proceden3,10. Puede ser inducida por
hipoxia, factores de crecimiento, estímulos inflamatorios y varios oncogenes como el proto-oncogén
Herb2-Neu2,15. En pacientes humanos los estudios
indican que la expresión de COX-2 es inapreciable
en tejido mamario normal pero aumenta en estadios pre-malignos, en carcinomas ductales, en carcinomas invasivos y en lesiones metastásicas2,3,10.
También se ha observado que la sobreexpresión
de COX-2 tiene lugar preferentemente en los casos
que presentan sobreexpresión del proto-oncogén
Herb2-Neu, lo cual se debería a la activación de
ciertas quinasas y vías metabólicas que estimulan
la transcripción de COX-22,16.Aproximadamente de
un 20 a un 30% de los cánceres de mama en humanos tienen amplificado y/o sobreexpresado el
proto-oncogén Herb2-Neu1,5. Este se asocia a incrementos en las tasas de proliferación, comportamientos más agresivos, independencia hormonal
y en algunos estudios, aumento de la resistencia
a determinados agentes quimioterápicos1,5,6,14. En
caninos su expresión en cáncer de mama fue correlacionada con un elevado índice mitótico lo que
lleva a una rápida progresión y mal pronóstico con
pobre respuesta a la quimioterapia14. También se
ha demostrado que juega un importante papel en
la carcinogénesis de la glándula mamaria canina6
.
La COX-2 produce el aumento de la capacidad invasora de un tumor mediante el incremento
de la actividad de las metaloproteínas (MMP)4, que
son enzimas responsables de la degradación de la
matriz de colágeno2,10,15. Estimula la angiogénesis, a
través de la producción excesiva del VEGF por parte
de las células tumorales, fenómeno fundamental para
el crecimiento de una neoplasia y el desarrollo de
metástasis7,10,11. El VEGF es considerado el mitógeno
más potente para células endoteliales. Su patrón de
expresión citoplasmático se incrementa en relación a
la agresividad tumoral7,11,12,. El proto-oncogén Herb2-
Neu también es capaz de estimular la expresión del
VEGF y mientras que el gen supresor p53 disminuye
la transcripción génica del VEGF inhibiendo el crecimiento neoplásico, la proteína p53 mutada tiene disminuida su capacidad de regular la transcripción del
VEGF, dando lugar a que las células tumorales respondan menos a los agentes antiangiogénicos14,17.
Las PGs derivadas de la COX-2 especialmente
la prostaglandina E2 (PGE2) induce la síntesis y secreción de VEGF por parte de fibroblastos y macrófagos,
y a su vez, el VEGF tiene la capacidad de inducir la expresión de COX-2 en las células endoteliales humanas,
con lo que constituyen un bucle de señalización molecular de importancia capital para la angiogénesis7,8,15. También afectan el sistema inmune por disminución en la proliferación de las células T y B y en la
producción de algunas citoquinas, entorpeciendo de
esta manera los procesos de presentación antigénica
y por tanto, favoreciendo el desarrollo de la neoplasia15. Las PGs estimulan la actividad de la aromatasa
aumentando la producción local de estrógenos8,9.
En pacientes humanos las altas concentraciones de
PGE2, si bien inducen al aumento local de estrógenos,
se han asociado a la pérdida de RE y RP y a un elevado
riesgo de padecer metástasis9
.
El objetivo del presente trabajo fue investigar la expresión del VEGF y de COX-2 para establecer
su relación con otros marcadores y para evaluar el
riesgo de metástasis en cáncer mamario canino.
MATERIALES Y MÉTODOS
Muestras
Se trabajó con 17 muestras histopatológicas pertenecientes a pacientes caninos con neoplasias mamarias
malignas provenientes del Servicio de Oncología General de la Facultad de Ciencias Veterinarias, Universidad de Buenos Aires. La
edad, raza, estado ginecológico y estadificación
clínica13 de las pacientes se detallan en la Tabla 1.
Tabla 1. Edad, raza, estado ginecológico y estadificación clínica de las pacientes.
*Castradas después de los 4 años de edad.
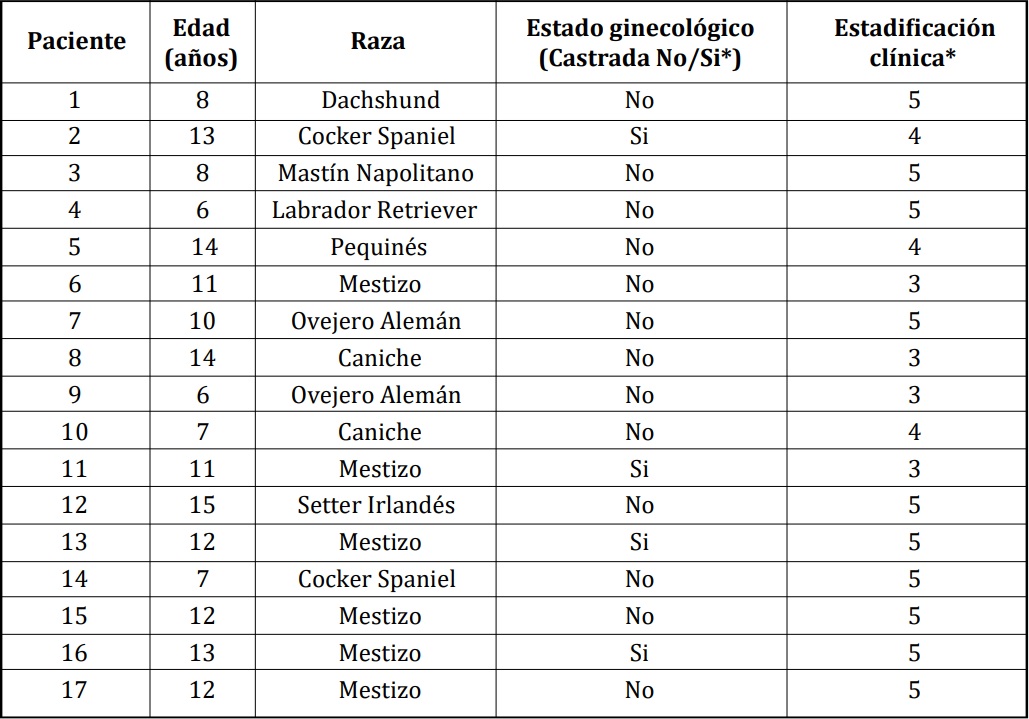
**Estadio clínico 1: T1 N0 M0. Estadio clínico 2: T2 N0 M0. Estadio clínico 3: T3 N0 M0. Estadio clínico 4: cualquier T
con N1 y M0. Estadio clínico 5: cualquier T con N1 y M113.
T: tumor primário. T1: < 3 cm de diámetro máximo. T2: 3 a 5 cm de diámetro. T3: > 5 cm de diámetro13.
N: linfonodos regionales. N0: sin metástasis histológica ni citológica. N1: con metástasis histológica o citológica13.
M: metástasis a distancia. M0: sin metástasis a distancia. M1: con metástasis a distancia13.
Histopatología
Las muestras de tejido mamario fueron
fijadas en formalina bufferada al 10 % y procesadas por el método histológico convencional.
Posteriormente los cortes de 5μm, se tiñeron con Hematoxilina-Eosina.
Inmunohistoquímica
Anticuerpos monoclonales utilizados
Anticuerpo monoclonal de ratón anti-VEGF (clon C-1), Santa Cruz, Biotechnology, CA, USA.
Anticuerpo monoclonal de ratón anti-COX-2
(clon 29), Santa Cruz, Biotechnology, CA, USA.
Anticuerpo monoclonal de ratón anti-p53
(clon EP9), Cell Marque, Rockling, CA, USA.
Anticuerpo monoclonal de conejo anti-RE
(clon SP1), Cell Marque, Rockling, CA, USA.
Anticuerpo monoclonal de conejo anti-RP
(clon Y85), Cell Marque, Rockling, CA, USA.
Anticuerpo monoclonal de ratón anti-
-Herb2-Neu (clon CB-11), Cell Marque, Rockling,
CA, USA.
Procesamiento de las muestras
Para la detección de RE, RP, Herb2-Neu y
p53 las secciones de tejido fueron desparafinadas
y rehidratadas. Para la recuperación antigénica se
utilizó la técnica de recuperación de epitopes inducida por calor (HIER) utilizando el reactivo Trilogy (Cell Marque) lo que permitió el desparafinado,
rehidratación y recuperación antigénica en forma
simultánea. Luego los portaobjetos se lavaron con
agua destilada y se incubaron con el anticuerpo primario correspondiente (Cell Marque, Rockling, CA,
USA) en una dilución 1:100 durante 1 hora a temperatura ambiente y se lavaron con Tris-solución
salina bufferada (TBS). El anticuerpo secundario
correspondiente (Cell Marque, Rockling, CA, USA)
se aplicó durante 10 minutos y luego los portaobjetos se lavaron nuevamente con TBS. El color fue
desarrollado a los 5 minutos de incubación con el
cromógeno. Por último, las muestras fueron deshidratadas y cubiertas con un cubreobjetos.
Para la detección del VEGF y de COX-2
las secciones de tejido fueron desparafinadas y
rehidratadas. Se realizó la técnica HIER utilizando
tampón de citrato de sodio 10 mM a pH 6.0 y a 95
°C durante 5 minutos. Posteriormente se lavaron
con agua desionizada. Luego se incubaron con el
anticuerpo primario correspondiente (Santa Cruz,
Biotechnology, CA, USA) en una dilución 1:100 durante 1 hora a temperatura ambiente y se lavaron
con TBS. El anticuerpo secundario correspondiente
(Santa Cruz, Biotechnology, CA, USA) se aplicó durante 10 minutos y luego fue lavado con TBS. El color fue desarrollado a los 5 minutos de incubación
con el cromógeno. Por último, las muestras fueron
deshidratadas y cubiertas con un cubreobjetos.
Para el control negativo se sustituyó el anticuerpo primario y como control positivo se utilizó una muestra con reactividad conocida frente al
anticuerpo primario.
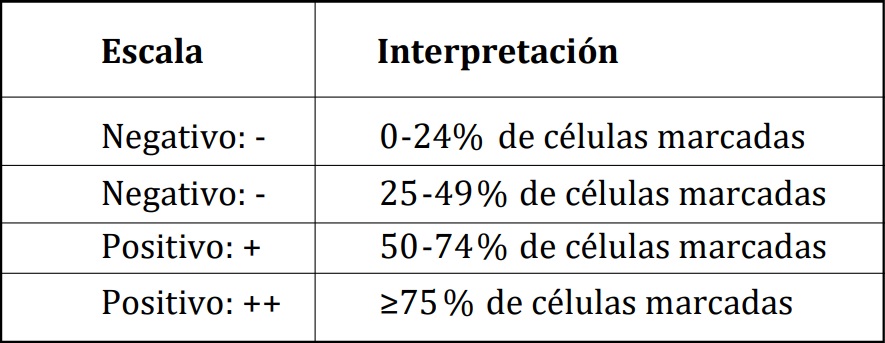
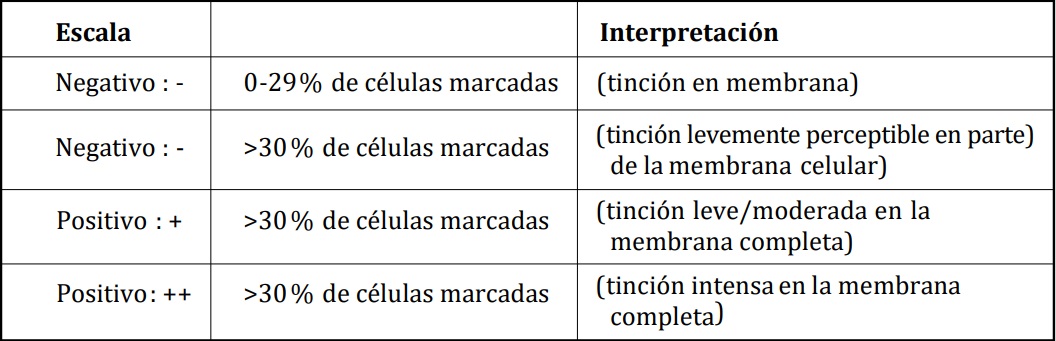
Evaluación de la inmunomarcación
Las muestras fueron evaluadas a bajo aumento (10x) y luego a mayor aumento (40x). Para
el VEGF (Figura 1a y b) se establecieron grupos a
partir del porcentaje de células marcadas. La interpretación de los resultados se detalla en la Tabla 2.
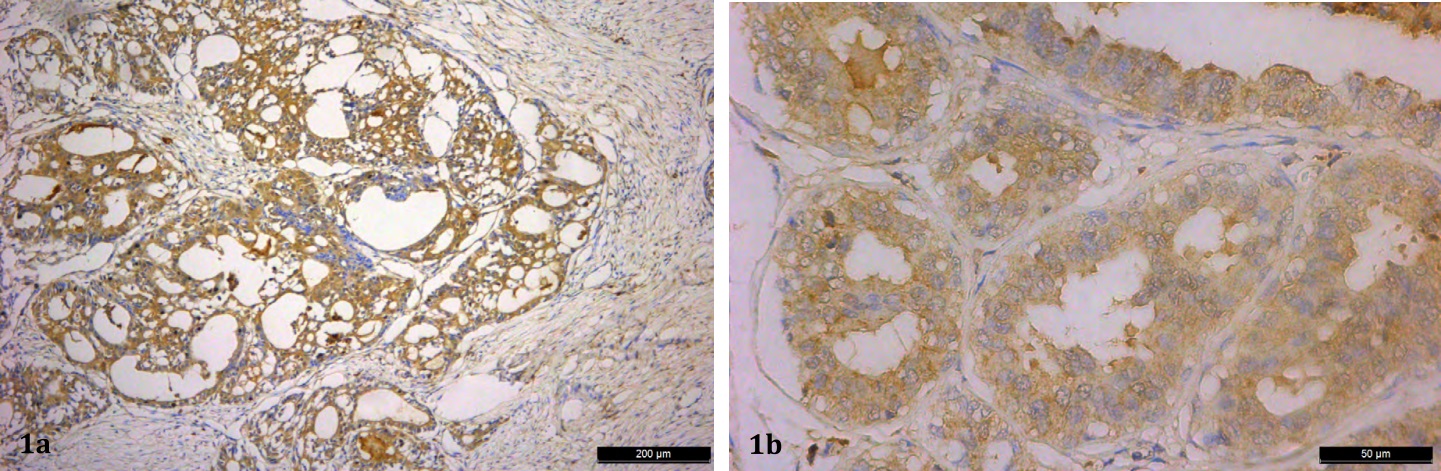
Figura 1a (10x) 1b(40x). Tejido neoplásico mamario maligno con expresión positiva para la tinción inmunohistoquímica de VEGF.
Tabla 2. Patrón de tinción para VEGF.
Para la COX-2 (Figura 2a y b) se valoró
la intensidad de la tinción citoplásmica y se establecieron los grupos 0: ausencia de tinción,
1: débil tinción, 2: moderada tinción y 3: fuerte
tinción. Luego se estimó el porcentaje de células
positivas para cada intensidad en 10 campos de
gran aumento y ese porcentaje se multiplicó por
la intensidad de tinción. La interpretación de los
resultados se detalla en la Tabla 3.
Para RE, RP, p53 y Herb2-Neu (Foto 3a y
b) se calculó el porcentaje de células con expresión positiva sobre un total de 3000 células. La
interpretación de los resultados se detalla en las
Tablas 4, 5 y 6.
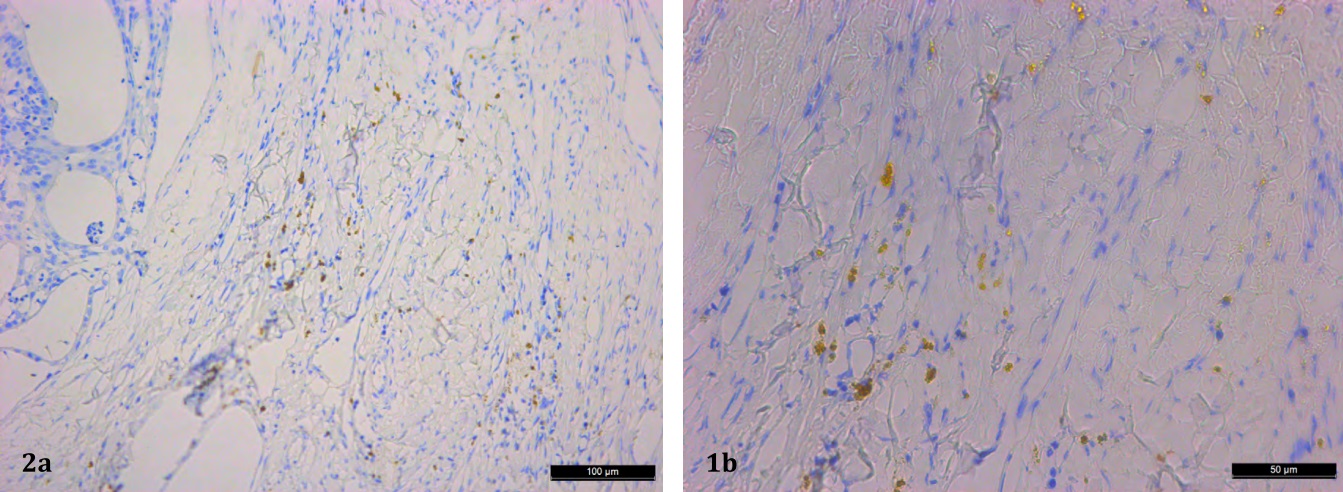
Figura 2a(20x) 2b(40x). Tejido neoplásico mamario maligno con expresión positiva para la tinción inmunohistoquímica de COX-2.
Tabla 3. Patrón de tinción para COX-2.
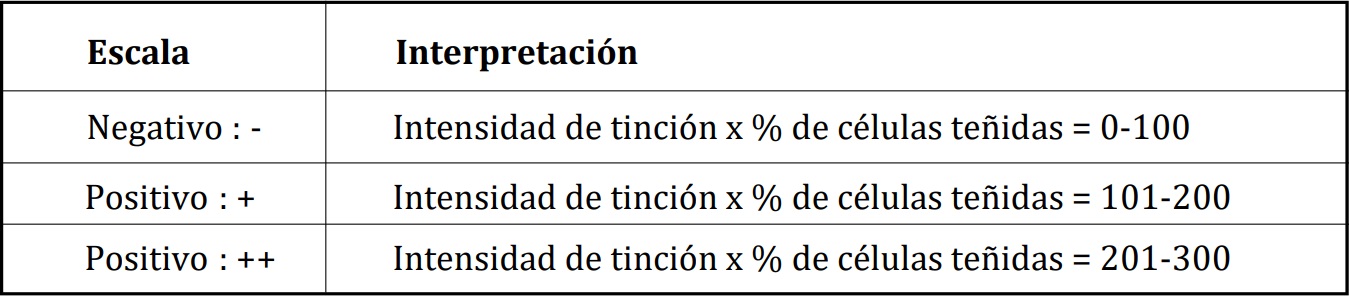
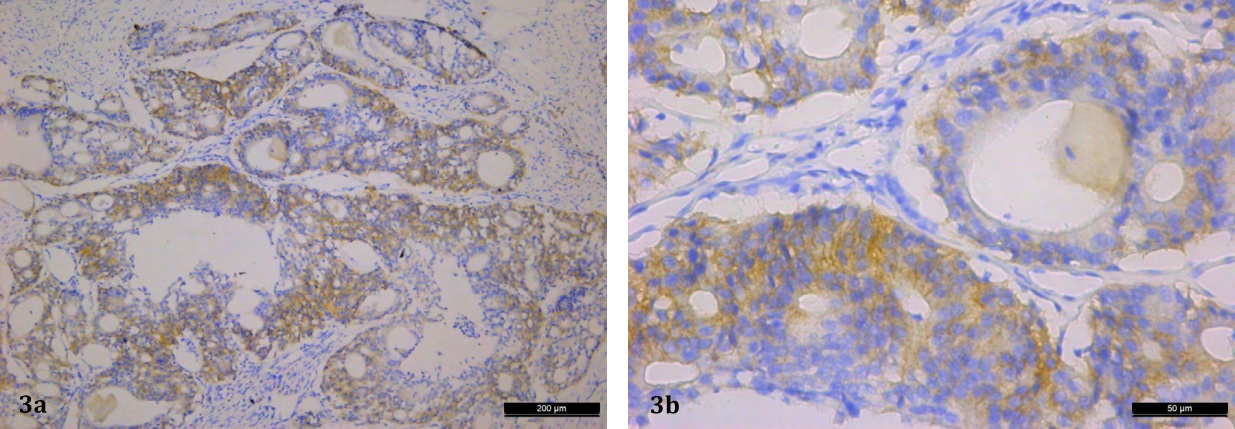
Figura 3a(10x) 3b(40x). Tejido neoplásico mamario maligno con expresión positiva para la tinción
inmunohistoquímica de Herb2-Neu.
Tabla 4. Patrón de tinción para receptores hormonales RE y RP.
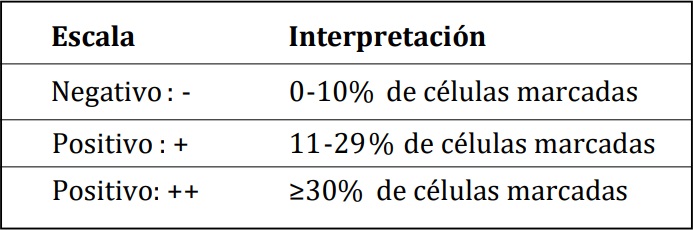
Tabla 5. Patrón de tinción para p53.
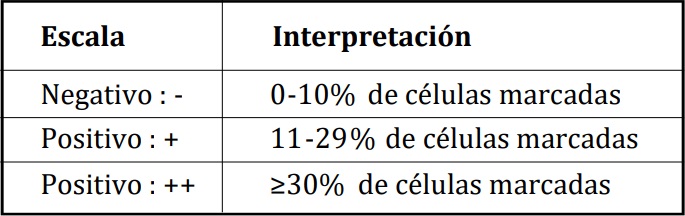
Tabla 6. Patrón de tinción para Herb2-Neu.
Análisis estadístico
Se realizó un análisis descriptivo de la situación con medidas de posición y con el estudio
de las frecuencias de distribución de los marcadores oncológicos determinados por inmunohistoquímica. Para evaluar sobrevida global de los grupos con expresión positiva y negativa de los marcadores oncológicos se empleó el método estadístico
de análisis de supervivencia de Kaplan Meier. La
comparación entre ellos se realizó mediante el Test
de Log-Rank y Cox-Mantel, considerándose significativos los p menores o iguales a 0,05. Se analizó
la correlación entre los resultados obtenidos de la marcación del VEGF y de COX-2 con la marcación
del gen mutante p53 y la sobreexpresión de Herb2-
Neu y la correlación entre la sobrevida global y la
expresión de los marcadores oncológicos, utilizando el coeficiente de correlación de Spearman
(Rho). Valores de Rho positivos (+) o negativos (-)
indicaron el sentido de la correlación. Rho (0,9 a
0,99) correlación muy alta (+/-), Rho (0,7 a 0,89)
correlación alta (+/-), Rho (0,4 a 0,69) correlación
moderada (+/-) y Rho (0,2 a 0,39) correlación baja
(+/-). Se consideraron significativos los p menores
o iguales a 0,05. Se determinó la prevalencia de los
distintos tipos histológicos de las neoplasias mamarias malignas halladas (carcinoma complejo,
carcinoma simple, carcinoma mixto y carcinoma
anaplásico)4
. Se realizó el estudio de las frecuencias de distribución de los marcadores oncológicos
en los distintos tipos histológicos18.
RESULTADOS
Del total (n=17) de muestras histopatológicas pertenecientes a pacientes con neoplasias mamarias malignas el 64,7 % (n=11/17)
presentaron expresión positiva para el VEGF, el
47 % (n=8/17) para COX-2, el 64,7 % (n=11/17)
para Herb2-Neu y el 76,5 % (n=13/17) para
p53. El 100 % (n=17/17) presentaron expresión negativa para RE y RP. La expresión del
VEGF, de COX-2, de Herb2-Neu, de p53 y la sobrevida global de los pacientes se detallan en
la Tabla 7. El grupo de pacientes con expresión
positiva para el VEGF, COX-2, Herb2-Neu y p53
presentó diferencias significativas en relación al
grupo con expresión negativa, con una mediana
de supervivencia de 175 y 850 días respectivamente. (p=0,009)
Tabla 7. Expresión de VEGF, COX-2, Herb2-Neu, p53 y sobrevida global de los pacientes.
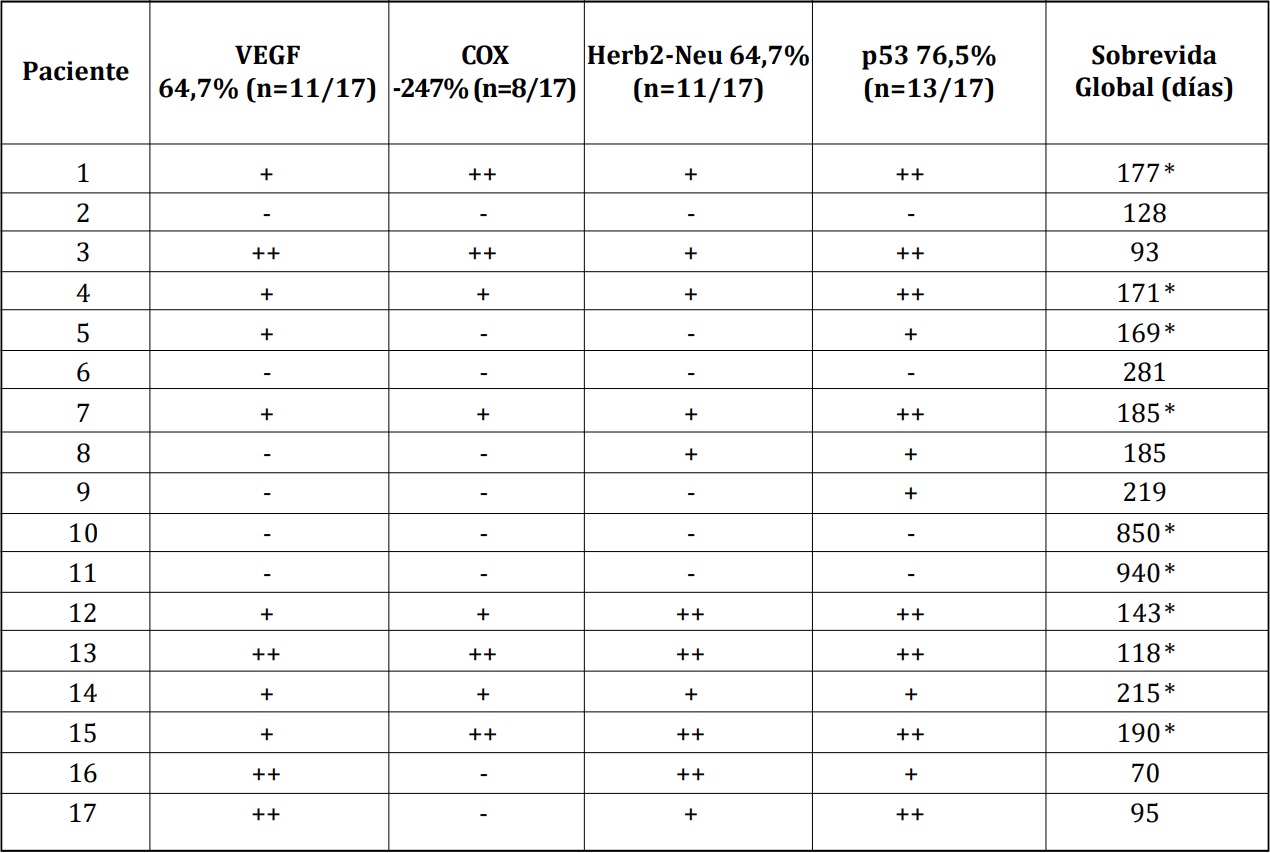
*Pacientes fallecidas al momento del estudio.
El tipo y grado histológico4
de las neoplasias mamarias malignas y su frecuencia se
detallan en la Tabla 8. El 57 % (n=4/7) de los
carcinomas simples y el 100 % (n=4/4) de los
carcinomas mixtos presentaron expresión positiva para el VEGF, COX-2, Herb2-Neu y p53 con
compromiso de linfonodos y metástasis mientras que el 100 % (n=2/2) de los carcinomas
anaplásicos presentaron expresión positiva para
el VEGF, Herb2-Neu y p53 y negativa para COX-2,
con compromiso de linfonodos y metástasis. Los
pacientes con carcinoma anaplásico recidivaron
desarrollando características clínicas de carcinoma inflamatorio mamario.
Tabla 8. Tipo, grado histológico y frecuencia de las neoplasias mamarias malignas.
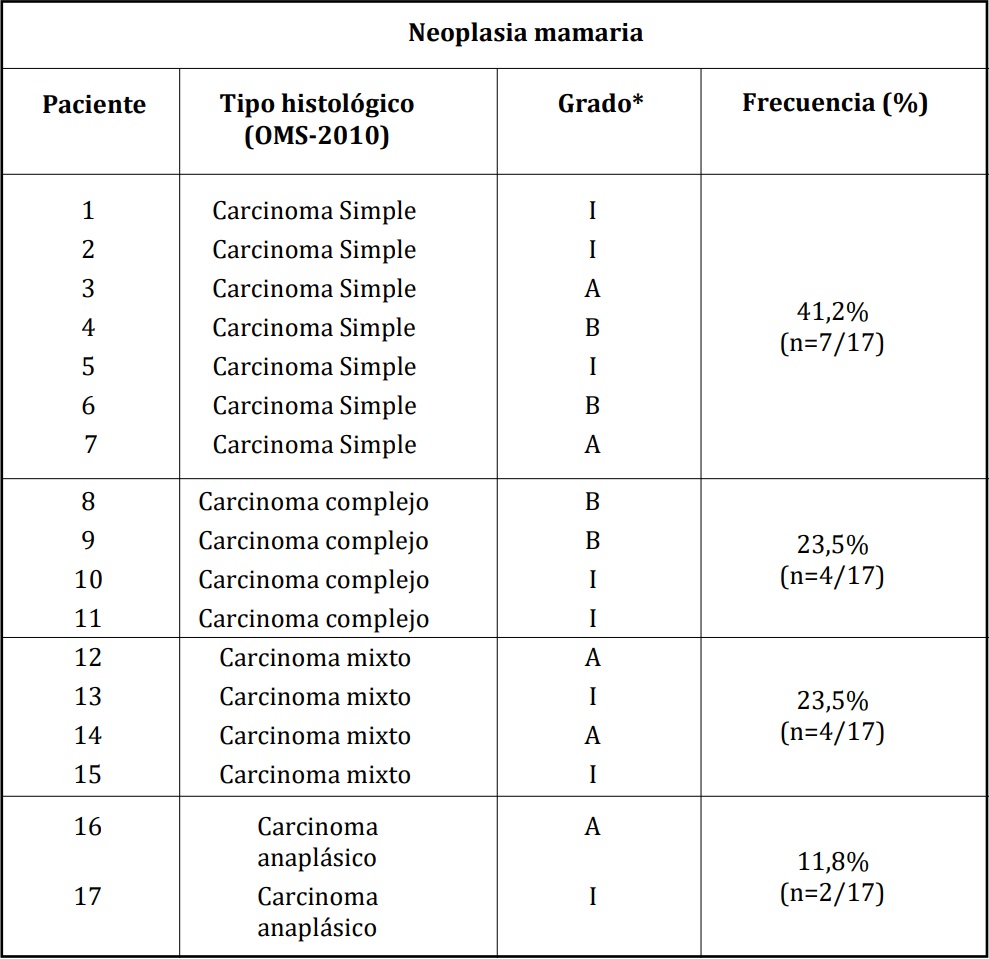
*Grado B: bajo (bien diferenciado). Grado I: intermedio (moderadamente diferenciado). Grado A: alto
(pobremente diferenciado)4.
Se observó una correlación positiva alta/
moderada entre los resultados obtenidos de evaluar la expresión del VEGF y de COX-2 con la expresión del p53 (Rho=0.73 p=<0,0013 y Rho=0.76
p=<0,0005 respectivamente) y con la sobreexpresión de Herb2-Neu (Rho=0.71 p=<0,0018 y
Rho=0.63 p=<0,007 respectivamente). Se observó una correlación negativa alta entre la sobrevida global y la expresión del VEGF (Rho=-0.77
p=<0,0004), una correlación negativa moderada
entre la sobrevida global y la expresión del p53
(Rho=-0.50 p=<0,041) y la sobreexpresión de
Herb2-Neu (Rho=-0.53 p=<0,030). Se observó una
correlación negativa baja entre la sobrevida global
y la expresión de la COX-2 (Rho=-0.22 p=<0,37).
CONCLUSIONES
En concordancia con la bibliografía consultada, la expresión positiva de VEGF, COX-2, Herb2-
Neu y p53 se asoció a la pérdida de receptores RE y
RP, corta sobrevida global, rápido crecimiento y progresión tumoral, con alta posibilidad de metástasis y
recidiva del tumor lo cual se observó en el 57 % de
los carcinomas simples y en el 100 % de los carcinomas mixtos positivos a la expresión de VEGF, COX-2,
Herb2-Neu y p53 y en el 100 % de los carcinomas
anaplásicos positivos a la expresión de VEGF, Herb2-
Neu y p532,6,9. Mientras el proto-oncogén Herb2-Neu
se asoció a un comportamiento más agresivo con
incremento en las tasas de proliferación e independencia hormonal, la COX-2 contribuyó aún más al
desarrollo de metástasis gracias a su habilidad para
regular la angiogénesis, favoreciendo el aporte sanguíneo necesario para la diseminación de las células
neoplásicas, lo cual se observó en los carcinomas
simples y en los carcinomas mixtos, pero también en
los carcinomas anaplásicos positivos a la expresión
de VEGF, Herb2-Neu y p53 aunque negativos a la expresión de COX-22,7,15. Los autores consultados señalan que altos niveles de COX-2 se asocian al fenotipo
inflamatorio pero esto no fue observado en los 2 pacientes con carcinoma anaplásico que desarrollaron
ese comportamiento clínico en el post-quirúrgico16.
Se requiere de más estudios que involucren un mayor número de pacientes que validen o no dichos hallazgos y permitan su justificación.
Se observó una correlación positiva entre
la expresión del VEGF y de COX-2 con la marcación
del gen mutante p53 y la sobreexpresión de Herb2-
Neu considerando que la expresión del VEGF y de
COX-2 puede ser inducida por el proto-oncogén
Herb2-Neu y que el 58,8 % de los pacientes con
neoplasias mamarias malignas presentaron amplificado y/o sobreexpresado el proto-oncogén
Herb2-Neu en un porcentaje mayor que el reportado por la bibliografía consultada1,5,6,14. Por otro lado,
si bien el gen supresor p53 disminuye la transcripción génica del VEGF inhibiendo el crecimiento
neoplásico, la proteína p53 mutada tiene disminuida su capacidad de regular la transcripción del
VEGF, dando lugar a que las células neoplásicas respondan menos a los agentes antiangiogénicos7,15.
Además la PGE2 derivada de la COX-2 también induce la síntesis y secreción del VEGF por parte de
fibroblastos y macrófagos, y a su vez, el VEGF tiene
la capacidad de inducir la expresión de COX-2 en las
células endoteliales humanas. Este bucle de señalización molecular es de importancia capital para la
angiogénesis7,8,15.
También, acorde a lo reportado en pacientes humanos y en caninos, se observó la pérdida
de RE y RP7,9. Si bien las altas concentraciones de
la PGE2 inducen al aumento local de estrógenos,
esto está asociado a la pérdida de RE y RP y a un
elevado riesgo de padecer metástasis8,9,15.
El estudio de estos marcadores permite
evaluar el riesgo de metástasis y mejora la predicción del tiempo de sobrevida libre de enfermedad.
No obstante se requiere de más estudios que involucren un mayor número de pacientes que validen
dichos hallazgos.
BIBLIOGRAFÍA
1. Andrea, GK.; Marko, H.; Branka, A.; et. al. Histopathological
evaluation and immunohistochemical study of estrogen
receptor α, HER-2 and Ki-67 in canine neoplastic mammary lesions. Veternarski Arhiv. 2011; 81(6):709-722.
2. De Nardia, AB.; Dalecka, CR.; Amorinb, RL.; et. al. Cyclooxigenase-2 expression in primary metastatic and non
metastatic canine mammarian carcinomas. Arch. Med.
Vet. 2013; 45(3):311-16.
3. Doré, M.; Lanthier, I.; Sirois, J. Cyclooxygenase-2 expression in canine mammary tumors. Veterinary pathology.
2003; 40(2):207-212.
4. Goldschmidt, M.; Peña, L.; Rasotto, R.; Zappulli, V. Classification and grading of canine mammary tumors. Veterinary pathology. 2011; 48(1):117-131.
5. Kabir, FML.; DeInnocentes, P.; Agarwal, P.; Mill, CP.;
Riese, DJ.; Bird, RC. Estrogen receptor-α, progesterone receptor, and c-erbB/HER-family receptor mRNA
detection and phenotype analysis in spontaneous
canine models of breast cancer. J. Vet. Sci. 2017;
30;18(2):149-58. doi:10.4142/jvs.2017.18.2.149.
6. Kaszak, I.; Ruszczak, A.; Kanafa, S.; Kacprzak, K.; Król,
M.; Jurka, P. Current biomarkers of canine mammary tumors. Acta Vet. Scand. 2018; 29;60(1):66. doi:10.1186/
s13028.018.0417.1.
7. Koutras, A.; Kotoula, V.; Fountzilas, G. Prognostic and
predictive role of vascular endothelial growth factor
polymorphisms in breast cancer. Pharmacogenomics.
2015; 16:79-94.
8. Lala, PK.; Nandi, P.; Majumder, M. Roles of prostaglandins
in tumor-associated lymphangiogenesis with special
reference to breast cancer. Cancer Metastasis Rev. 2018
Sep; 37(2,3):369-84. doi:10.1007/s10555.018.9734.0.
9. Lange, CA. Integration of progesterone receptor action with
rapid signaling events in breast cancer models. J. Steroid Biochem. Mol. Biol. 2007; 108:203-12.
10. Lavalle, GE.; Bertagnolli, AC.; Tavares, WLF.; Cassali, GD.
Cox-2 expression in canine mammary carcinomas: correlation with angiogenesis and overall survival. Veterinary Pathology. 2009; 46(6):1275-1280.
11. Moschetta, MG.; Maschio, LB.; Jardim-Perassi, BV.; et. al.
Prognostic value of vascular endothelial growth factor
and hypoxia-inducible factor 1α in canine malignant
mammary tumors. Oncology Reports. 2015; 33:2345-53.
12. Muhammadnejad, A.; Keyhani, E.; et. al. Overexpression
of her-2/neu in malignant mammary tumors; translation of clinicopathological features from dog to human.
Asian Pac. J. Cancer Prev. 2012; 13(12): 6415-21.
13. Owen, LN. TNM Classification of Tumors in Domestic
Animals. 1st ed. Geneva, Switzerland: World Health Organization. 1980:1-53.
14. Pradilla, O. E. Ciclooxigenasa 3: La nueva iso-enzima en
la familia. MedUNAB. 7(21):181-184. En: https://revistas.unab.edu.co/index.php/medunab/article/view/216
(Consultado el 27octubre2021).
15. Queiroga, F.; Pires, I.; Parente, M.; Gregório, H.; Lopes,
CS. COX-2 over-expression correlates with VEGF and
tumour angiogenesis in canine mammary cáncer. Vet.
Journal. 2011; 189(1):77-82.
16. Raposo, TP.; Pires, I.; Prada, J.; Queiroga, FL.; Argyle, DJ.
Exploring new biomarkers in the tumour microenvironment of canine inflammatory mammary tumours. Vet.
Comp. Col. 2017; 15:65-66.
17. Santos, AA.; Lopes, CC.; Ribeiro, JR.; et. al. Identification of prognostic factors in canine mammary
malignant tumours: a multivariable survival study. BMC
Vet. Res. 2013 Jan; 9:1. doi:10.1186/1746.6148.9.1.
18. Watson, P.; Petri, A. Statistic for Veterinary and Animal Science, 2nd ed. Blackwell Science, London. 2000.










