ARTÍCULO DE INVESTIGACIÓN
Ventilación dual en conejos con condiciones pulmonares heterogéneas.
Evaluación del dispositivo ACRA. Estudio preliminar.
Tarragona, L1; Ceballos, M1; Zaccagnini, A1; Biondini, N2; Diaz, A1; Costoya, A1; Artana, G3; Otero, P1.
1
Universidad de Buenos Aires, Facultad de Ciencias Veterinarias, Cátedra de Anestesiología y Algiología. Buenos Aires.
Argentina.
2
Asociación de Anestesia, Analgesia y Reanimación de Buenos Aires (AAARBA). Buenos Aires. Argentina.
3
Universidad de Buenos Aires - CONICET, Laboratorio de Fluidodinámica, Facultad de Ingeniería. Buenos Aires, Argentina
Recibido: 15/07/2021
Aceptado: 17/11/2021
Correspondencia e-mail: Lisa Tarragona ltarragona@fvet.uba.ar
Resumen
La actual pandemia de COVID-19 ha llevado al planeta a una escasez mundial de respiradores. Se ha
abogado por compartir respiradores como alternativa para hacer frente a este aumento repentino de
pacientes graves que requieren asistencia ventilatoria. Para subsanar esta contingencia mundial han sido
propuestos diferentes enfoques terapéuticos. Este estudio describe el rendimiento de una nueva interfaz
denominada ACRA (Ampliación de Capacidades de los Respiradores Artificiales), diseñada específicamente para dividir el flujo de salida de un respirador en dos sistemas de ventilación, superando varias de
las limitaciones que podrían surgir de una ventilación dual. El objetivo fue evaluar la capacidad del ACRA
de garantizar la provisión de una estrategia de ventilación protectiva independiente y simultánea a dos
conejos con diferentes condiciones pulmonares. El experimento consistió en interponer el dispositivo
ACRA entre un respirador mecánico y dos conejos anestesiados con condiciones pulmonares heterogéneas. La ventilación se realizó en modalidad controlada por presión. En todas las fases, los valores de presión individuales se obtuvieron de los manómetros analógicos de la interfaz y los de volumen corriente se
obtuvieron del respirador, lo que se corroboró con los datos obtenidos de sensores de flujo adicionales.
Se evaluaron las variables ventilatorias y hemodinámicas durante dos horas de ventilación. En el modelo experimental ensayado, la división del flujo de salida del respirador, los ajustes de presión independientes y la administración individual del volumen corriente fueron factibles, a pesar de la heterogénea
condición pulmonar de los individuos testeados. La interposición del ACRA permitió la ejecución de una
ventilación pulmonar protectiva y la preservación del equilibrio hemodinámico. Aunque la ventilación
dual solo ha sido sugerida durante una crisis grave del sistema sanitario, este experimento propone al
dispositivo “ACRA” como una alternativa para ampliar la capacidad de los respiradores en situaciones de
emergencia, individualizando las necesidades de cada paciente.
Palabras clave: : COVID-19, distrés respiratorio, lagomorfos, interfaz, ventilación compartida
Dual ventilation in rabbits with heterogeneous pulmonary conditions.
Evaluation of the ACRA device. Preliminary study.
Summary
The current COVID-19 pandemic has led to a worldwide shortage of ventilators. Ventilator sharing has been
advocated as an alternative to cope with this sudden increase in critically ill patients requiring ventilatory
assistance. To handle this worldwide contingency, different therapeutic approaches have been proposed.
This study describes the performance of a new interface called ACRA (Artificial Respirator Capability Enhancement), specifically designed to split the outflow of a ventilator into two breathing systems, overcoming several of the limitations that could arise from dual ventilation. The aim was to evaluate the capacity
of the ACRA to guarantee the provision of an independent and simultaneous protective ventilation strategy
in two rabbits with different pulmonary conditions. The experiment consisted of placing the ACRA device
between a mechanical ventilator and two anesthetized rabbits with heterogeneous pulmonary conditions.
Ventilation was performed in a pressure-controlled mode. In all phases, individual pressure values were
obtained from the interface analog manometers and tidal volume values were obtained from the ventilator, which was verified with data obtained from additional flow sensors. Ventilatory and hemodynamic
variables were evaluated during two hours of ventilation. In the experimental model tested, division of the
ventilator outflow, independent pressure adjustments, and individual administration of tidal volume were
feasible, despite the heterogeneous lung condition of the individuals tested. The interposition of the ACRA
allowed the execution of a protective pulmonary ventilation and the preservation of the hemodynamic balance. Although dual ventilation has only been suggested during a serious crisis in the healthcare system,
this experiment proposes the ACRA device as an alternative to expand the capacity of ventilators in emergency situations, individualizing the needs of each patient.
Key words: : COVID-19, respiratory distress, lagomorphs, interface, shared ventilation
INTRODUCCIÓN
El advenimiento de la pandemia de COVID-19 ha llevado al planeta a una escasez de
respiradores y a la necesidad de plantear alternativas de soporte ventilatorio a nivel mundial.
Los primeros reportes de co-ventilar a más de un
individuo con un único respirador, ya sea con la
utilización de simuladores o en animales por un
breve período de tiempo, fue realizado por varios
investigadores, sin lograr individualizar las variables respiratorias para cada una de las unidades
conectadas5, 17, 19.
Con el avance de la pandemia, el incremento en la demanda de respiradores en las
unidades de cuidados intensivos incentivó a distintos grupos de investigadores8-10 a revisar y
desarrollar la posibilidad de amplificar las capacidades de estos dispositivos, ante una situación
sanitaria extrema. Actualmente esta estrategia
está siendo considerada y ha sido recientemente
autorizada por parte de la FDA (the United States
Food & Drug Administration) que ha avalado su
utilización en este contexto de crisis29. A pesar de
los avances alcanzados no hay a la fecha publicaciones sobre el empleo de dispositivos de ventilación dual empleados en modelos animales.
En este estudio se empleó una nueva interfaz denominada ACRA (Ampliación de Capacidades de los Respiradores Artificiales), diseñada
específicamente para dividir el flujo de salida de
un respirador en dos circuitos respiratorios, superando varias de las limitaciones que podrían surgir de la ventilación dual propuesta originalmente.
El objetivo del presente trabajo fue evaluar la
capacidad del ACRA de proveer una ventilación simultánea, protectiva e independiente a dos conejos con
diferentes condiciones pulmonares. Adicionalmente,
se monitorizaron las variables hemodinámicas y la
aireación pulmonar durante la ventilación dual.
MATERIALES Y MÉTODOS
Esta experiencia fue aprobada por el Comité Institucional de Cuidado y Uso de Animales de Experimentación (CICUAL) de la Facultad de Ciencias
Veterinarias de la Universidad de Buenos Aires (Protocolo Nº 2019/18).
Descripción del dispositivo ACRA
El ACRA fue diseñado para dividir el flujo
de salida de un respirador en dos sistemas de respiración. Esta interfaz ACRA se construyó con material
descartable aprobado para uso médico por la FDA. El
dispositivo se interpone entre un respirador mecánico
y dos circuitos respiratorios convencionales, posibilitando, a través de la restricción de flujo, individualizar
la presión inspiratoria pico (PIP) y la presión positiva
al final de la espiración (PEEP) de cada unidad ventilada. Para lograrlo, cuenta con cuatro válvulas unidireccionales, una válvula de PEEP ubicada en la rama
espiratoria de uno de los circuitos y dos válvulas restrictoras de flujo diseñadas ad hoc. La presión inspiratoria de cada unidad se controla mediante el ajuste
manual de la válvula restrictora de flujo de cada rama
inspiratoria. Así, la PIP alcanzada en cada unidad será
igual o menor a la configurada en el respirador. La válvula ajustable de PEEP se interpone en la rama espiratoria del circuito respiratorio de la unidad pulmonar
que requiera mayor PEEP. La PEEP del circuito respiratorio que no posee PEEP ajustable corresponderá al
valor programado en el respirador, mientras que en el
otro circuito la PEEP será la sumatoria de la PEEP del
respirador más el valor configurado en la válvula de
PEEP del ACRA. Para la determinación del diferencial
de presión (DP) de cada unidad ventilada, la interfase
cuenta con dos manómetros analógicos que miden
respiración a respiración la evolución de la presión en
cada uno de los circuitos respiratorios del sistema. En
la figura 1 se ilustra el diagrama del ACRA
Animales
Se incluyeron dos conejos hembras de raza
New Zealand de 3,5 y 4 kg.
Preparación del modelo animal
Con el objetivo de disminuir el estrés, cada
animal fue medicado con dexmedetomidina (30
µg/kg) y midazolam (2 mg/kg) por vía intramuscular. Logrado un adecuado nivel de sedación, se
realizó la canalización de ambas venas y arterias
auriculares, y de la vena cefálica antebraquial derecha. Luego de 5 minutos de preoxigenación con
máscara facial, se realizó la inducción anestésica
con propofol por vía endovenosa (5 - 7 mg/kg)
hasta lograr la permeabilización de la vía aérea con
la utilización de una máscara laríngea (V-Gel® Advanced Supraglottic Airway Device- Rabbit Nº 3). A
continuación, se conectó a un circuito lineal de no
reinhalación con una fracción inspirada de oxígeno
(FiO2
) de 1,0 y un flujo de gases frescos (FGF) de
3 L/min en ventilación espontánea. Cada animal
fue posicionado en decúbito dorsal y conectado
a un monitor multiparamétrico para la medición
de las siguientes variables: frecuencia cardíaca
(FC) y trazado electrocardiográfico, porcentaje de
hemoglobina saturada con oxígeno (SpO2
), concentración de dióxido de carbono al final de la espiración (EtCO2
), presión arterial sistólica (PAS),
diastólica (PAD) y media (PAM) y temperatura corporal central (T). El mantenimiento de la anestesia
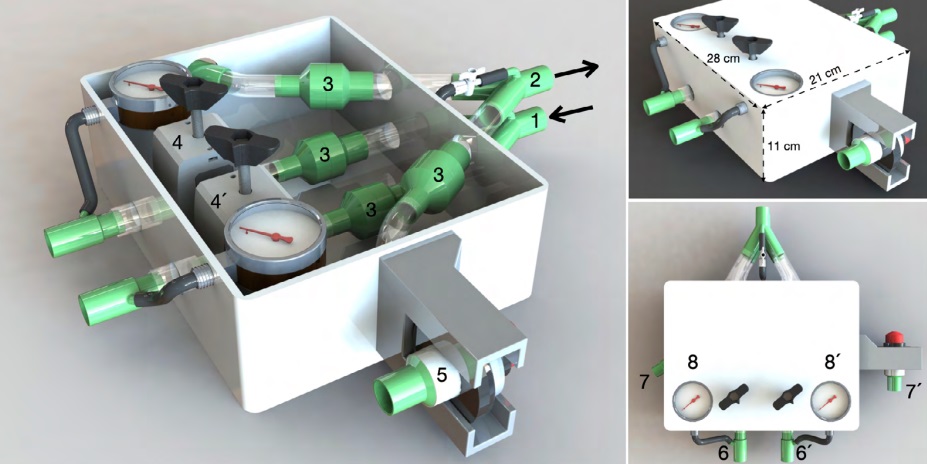
Figura 1: Descripción del dispositivo ACRA 1. Conexión de rama inspiratoria del ventilador, 2. Conexión de rama espiratoria del
ventilador, 3. Válvulas unidireccionales (inspiratorias y espiratorias), 4 y 4´. Válvulas restrictoras de flujo, 5. Válvula de PEEP, 6 y 6´.
Conexión de rama inspiratoria hacia el paciente, 7 y 7´. Conexión de rama espiratoria desde el paciente, 8 y 8´. Manómetros analógicos.
se realizó mediante una infusión continua endovenosa de propofol (0,5 - 0,8 mg/kg/min) y remifentanilo (0,25 µg/kg/min). Para la fluidoterapia de
mantenimiento se utilizó una solución de Ringer
lactato a un flujo de 5 mL/kg/h. Adicionalmente,
para garantizar un nivel de PAM mayor a 60 mmHg
se utilizó una infusión intravenosa de norepinefrina (0,01 – 0,1 µg/kg/min).
A continuación, se realizó una traqueostomía, previa infiltración con lidocaína 1% (0,3 mL/
kg) en el tejido celular subcutáneo en la zona de
incisión. La misma fue realizada según técnica habitual, con la colocación de un tubo endotraqueal
de 3,5 mm de diámetro interno sin balón de neumotaponamiento y fijado mediante dos suturas a
la tráquea para prevenir fugas de gases. Se descartó la presencia de fugas mediante el análisis de las
curvas de presión/tiempo y de flujo/tiempo generadas en la máquina de anestesia.
Protocolo experimental
Esta experiencia consistió en dos pasos.
Se empleó una dupla de animales (A y B).
Paso 1:
Configuración/Seteo/Programación de ventilación dual.
La experiencia se realizó en ventilación controlada por presión (VCP).
El respirador se programó inicialmente con una PIP de 35 cmH2O (mayor a la requerida por las unidades a ventilar), PEEP de 5
cmH2O, una relación inspiración: espiración (I:E) de
1:1, FiO2=0,4 y una frecuencia respiratoria (fR)
para mantener EtCO2 entre 35 y 45 mmHg.
Inicialmente, con el dispositivo ACRA interpuesto entre el respirador y el circuito respiratorio, se cerraron ambas válvulas restrictoras de
flujo. Inmediatamente después de que el animal
A se conectó a su circuito respiratorio correspondiente, se abrió manualmente la válvula restrictora
de flujo generando tanta presión como la necesaria
para obtener un volumen corriente espirado (VTe)
de 6 - 8 mL/kg (VTe A). A continuación, se conectó
al animal B de la misma manera y se abrió su válvula restrictora de flujo generando tanta presión
como la necesaria para obtener un VTe de 6 - 8 mL/
kg (VTe B). Este último valor se calculó a partir del
incremento de volumen mostrado en la pantalla del
ventilador (VTe B = Global VTe - VTe A). Para garantizar una adecuada adaptación a la ventilación
mecánica se empleó una infusión continua de vecuronio de 100 µg/kg/hora. Después de un breve
período de estabilización, se registraron los datos
de cada animal y se consideraron como valores de
referencia (T0). El nivel de la PEEP de cada animal
fue determinado en función de los valores de complacencia de cada uno de ellos.
Paso 2:
Ventilación dual en modelo heterogéneo.
Con el fin de generar un modelo de
ventilación heterogéneo, a uno de los conejos de la
dupla (conejo B), se le indujo un distrés respiratorio
agudo (SDRA) mediante el lavado de surfactante
pulmonar. Para lograrlo se empleó solución salina
normal (15 - 20 mL/kg a 37°C), como fue descrito
previamente por Lanchman et al12. Se repitieron
tantos lavados como los necesarios para lograr una
relación entre la presión arterial de oxígeno y la
fracción inspirada de oxígeno (PaO2/FiO2) entre 300
y 200. Se registraron los valores de gasometría en el
conejo B en el momento del distrés. La ventilación dual
se mantuvo durante 120 minutos post distrés. En el
transcurso de la experiencia se realizaron ajustes de
las válvulas restrictoras de flujo y PEEP del ACRA, así
como también en la configuración del respirador para
garantizar el Vte propuesto teniendo en cuenta otras
variables (gasometría, ETCO2 y DP). Se registraron los
valores de las variables hemodinámicas, respiratorias,
espirometría, gasometría arterial y ultrasonografía
pulmonar y cardíaca a los 20, 60 y 120 minutos de
ventilación dual post distrés (T20, T60 y T120). Los
manómetros analógicos del ACRA permitieron un
seguimiento continuo e individualizado de PIP y
PEEP de cada conejo.
Registro de variables de estudio
Para el registro de las variables hemodinámicas y respiratorias se emplearon los monitores multiparámetricos (Digicare Lifewindow(™)
9X, Digicare, USA; AvanceCS2, General Electric,
USA y Massimo RAD-7). Cada animal dispuso de
un monitor independiente. Las variables estudiadas en los diferentes momentos fueron:
• FC: frecuencia cardíaca, determinada mediante
electrocardiografía de tres vías o electrodos.
• T: temperatura central, con sonda colocada a
través del recto hasta llegar al colón.
• PAS, PAD y PAM: mediante el catéter arterial
colocado en la arteria auricular izquierda. Para
ello se implementó un domo de presión que
fue colocado a la altura del corazón y se realizó
la puesta a cero al inicio de cada experiencia.
• SpO2: saturación arterial de oxígeno, con sensor pediátrico colocado en la base de la cola.
• EtCO2: mediante medición de flujo lateral.
Las variables de espirometría se determinaron mediante la máquina AvanceCs2 (General
Electric, USA). Las variables estudiadas en los
diferentes momentos fueron:
• VTe: volumen corriente espirado
• PIP, DP y PEEP
• Resistencia (RVA) y complacencia respiratoria
dinámica (CDIN)
Para la determinación de la gasometría arterial
se empleó un analizador portátil (OPTI CCA BG
Analizadores, Argentina). Las variables registradas durante la experiencia fueron: presión
parcial de oxígeno (PaO2
), presión parcial de
dióxido de carbono (PaCO2
) y pH. Se realizó la
corrección de la temperatura, antes de ingresar la muestra. La muestra de sangre (0,5 mL)
se recogió desde uno de los puertos del catéter
arterial derecho, con una jeringa heparinizada
previo descarte de 1 mL de sangre.
Para el estudio de la aireación pulmonar se empleó
un ecógrafo M-Turbo (SonoSite, Inc., WA, Estados
Unidos) con un transductor lineal de 6-13 mHz.
Un mismo operario realizó todas las exploraciones
ultrasonográficas. El escaneo se realizó en seis regiones (ventral, media y superior de ambos hemitórax). Para lograr un adecuado acople de la sonda,
la piel del tórax fue rasurada y acondicionada con
alcohol y gel. El índice de aireación pulmonar empleado contempló cuatro categorías que fueron
asignadas de la siguiente manera, como fuera descripto previamente por Monastesse et al.16:
• Aireación normal (0), con la presencia de hasta dos líneas B por espacio intercostal.
• Leve pérdida de la aireación (1) con más de
dos líneas B o presencia de una o múltiples
consolidaciones subpleurales separadas por
una línea pulmonar normal.
• Moderada pérdida de la aireación pulmonar (2)
caracterizada por la presencia de líneas B coalescentes o múltiples consolidaciones subpleurales separadas por una línea pleural irregular.
• Severa pérdida de la aireación pulmonar (3)
con consolidaciones o pequeñas consolidaciones subpleurales.
Se registró el índice de aireación pulmonar de
cada región y la sumatoria completa de las seis
regiones (ver figura 2) para cada animal durante los cuatro momentos de la experiencia.
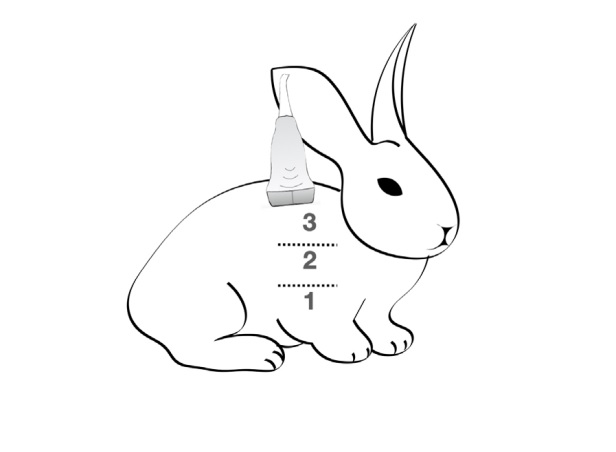
Figura 2: Se muestran en el esquema las diferentes zonas
pulmonares evaluadas mediante ultrasonografía transtorácica en un conejo.
Para la evaluación hemodinámica a través de
la ultrasonografía se empleó un ecógrafo M-Turbo (SonoSite, Inc., WA, Estados Unidos) con un transductor
sectorial Phased Array de 2-5 mHz. Todas las determinaciones ecocardiográficas fueron realizadas por el
mismo operador. Se evaluó la integral velocidad-tiempo del flujo aórtico (IVTAo)empleando Doppler pulsado a nivel del tracto de salida del ventrículo izquierdo,
a través de una imagen de 5 cámaras en una ventana
subxifoidea (ver Figura 3). Luego, multiplicando estos
valores por la FC en cada tiempo se obtuvieron los datos de la distancia por minuto.
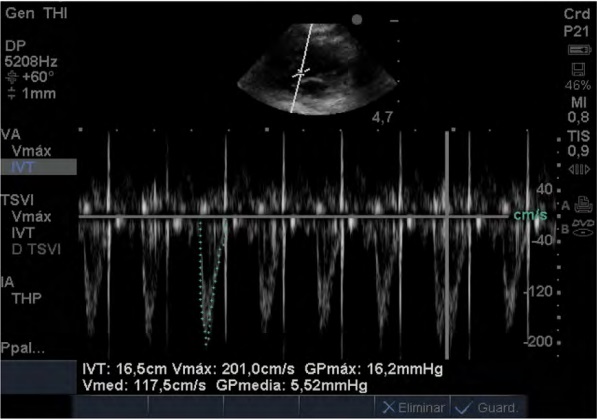
Figura 3: Se muestra la medición de la integral velocidad tiempo (IVTAo) mediante Doppler pulsado, a
través de una imagen ecocardiográfica de 5 cámaras mediante una ventana subxifoidea. Se observa la ubicación
del gate del Doppler pulsado a nivel del tracto de salida
del ventrículo izquierdo.
RESULTADOS
Los resultados de todas las variables
registradas en cada tiempo (T0, T20, T60 y
T120) para cada animal fueron presentados como
gráficos de barras y tablas. (Graph Pad Prism 8.1.0).
Los valores de gasometría del conejo B luego del lavado pulmonar se presentan en la tabla 1.

Tabla 1: Valores de gasometría del conejo B luego de los lavados pulmonares. Presión arterial de oxígeno (PaO2);
presión arterial de dióxido de carbono (PaCO2), relación entre la presión arterial de oxígeno y la fracción inspirada
de oxígeno (PaO2/FiO2)
El dispositivo ACRA permitió independizar la PIP, PEEP, DP y el VTe durante una
estrategia de ventilación protectiva independiente y simultánea a cada conejo (A y B). Los
manómetros analógicos resultaron adecuados
para garantizar un seguimiento continuo e individualizado de PIP y PEEP de los conejos ventilados (Ver figura 4).
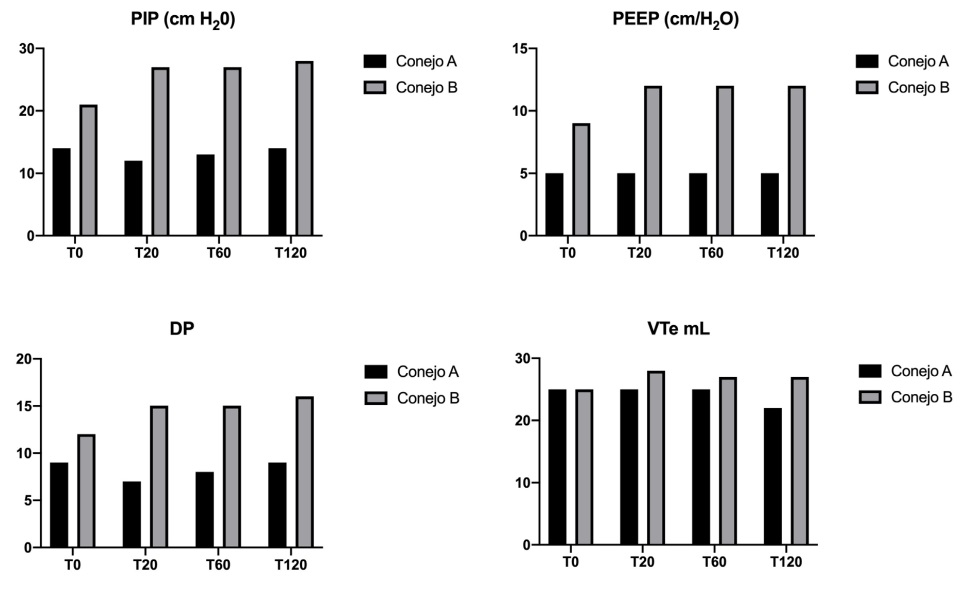
Figura 4: Evolución de los valores de presión inspiratoria pico (PIP), presión positiva al final de la espiración
(PEEP), diferencial de presión (DP) y volumen corriente espirado (VTe) en conejos ventilados simultáneamente. Conejo A: sin SDRA. Conejo B con SDRA. T0: sin distrés, T20: 20 min. post distrés, T60: 60 min.
post distrés, T120: 120 min. post. distrés.
Los valores de resistencia (RVA) y complacencia respiratoria dinámica (CDIN) registrados en cada tiempo se muestran en la figura 5.
La evolución de las variables de intercambio gaseoso se presenta en la figura 6.
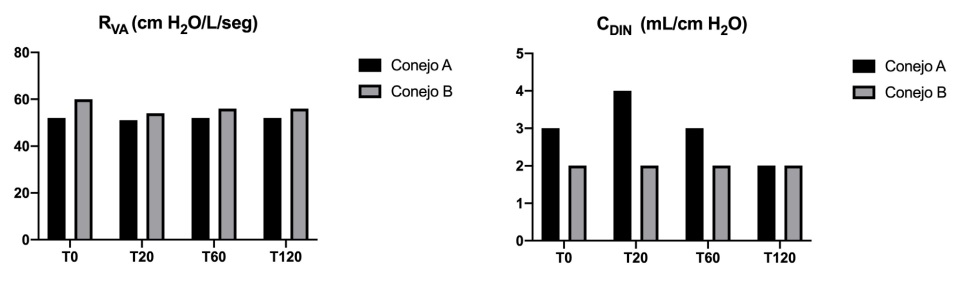
Figura 5: Valores de resistencia (RVA) y complacencia respiratoria dinámica (CDIN) en conejos ventilados simultáneamente. Conejo A: sin SDRA. Conejo B con SDRA. T0: sin distrés, T20: 20 min. post distrés, T60: 60
min. post distrés, T120: 120 min. post distrés.
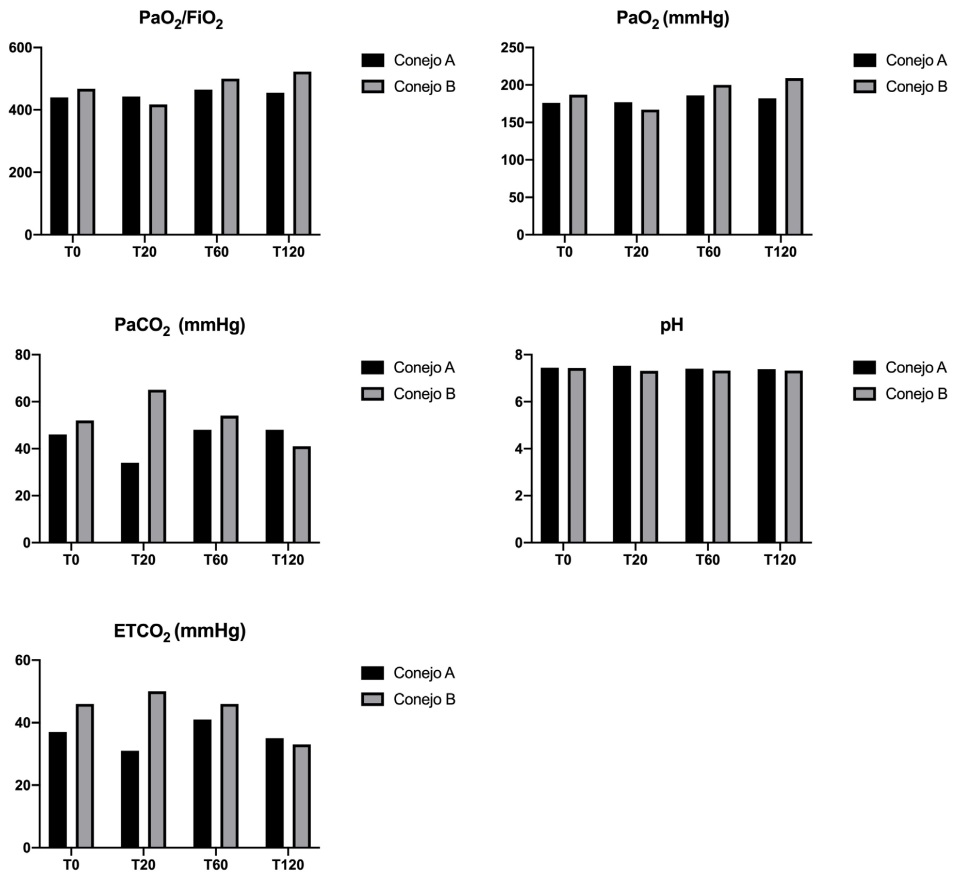
Figura 6: Valores de la relación entre la presión arterial
de oxígeno y la fracción inspirada de oxígeno (PaO2/FiO2), presión arterial de oxígeno en sangre arterial
(PaO2), presión arterial de dióxido de carbono en sangre arterial (PaCO2), pH arterial y concentración de
dióxido de carbono al final de la espiración (EtCO2).
Conejo A: sin SDRA. Conejo B con SDRA. T0: sin
distrés, T20: 20 min. post distrés, T60: 60 min. post
distrés, T120: 120 min. post con distrés.
Los valores de las variables respiratorias
y hemodinámicas evaluadas en las diferentes situaciones y tiempos se mantuvieron dentro del
rango de normalidad para la especie en condiciones de anestesia y ventilación mecánica. Los mismos se muestran en la tabla 2.
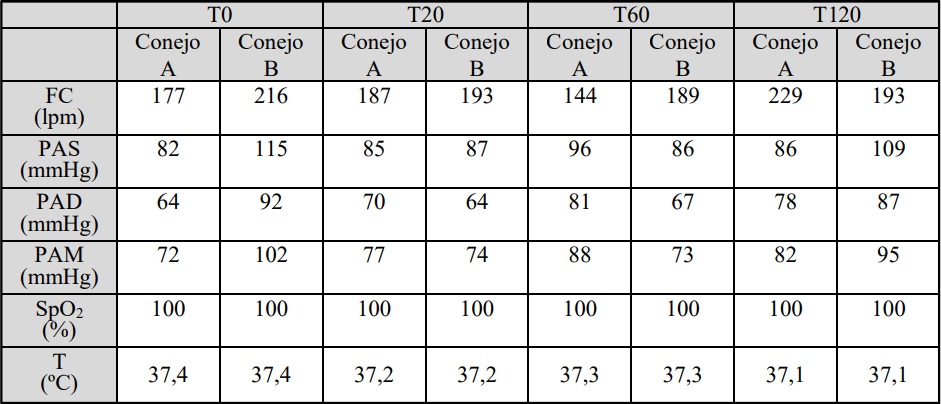
Tabla 2: Valores de frecuencia cardíaca (FC), Presión arterial sistólica (PAS), diastólica (PAD) y media (PAM), temperatura
(T) y saturación arterial de oxígeno (SpO2). Conejo A sin SDRA. Conejo B con SDRA. T0: sin distrés, T20:20 min. post
distrés, T60: 60 min. post distrés, T120: 120 min. post distrés.
Los índices de la aireación pulmonar se
detallan en la tabla 3. La evolución del IVTAo durante la experiencia se muestra en la figura 7.
Los valores obtenidos de distancia por minuto resultantes de la multiplicación del IVTAo por
la FC se muestran en la tabla 4.
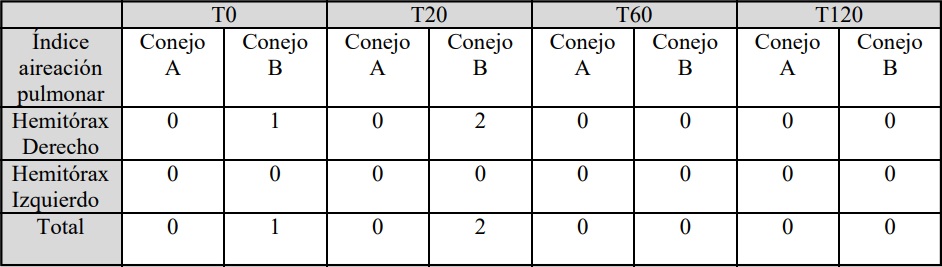
Tabla 3: Evolución de los valores de los índices de la aireación pulmonar de ambos hemitórax de los conejos A: sin
SDRA y B con SDRA. (0): Aireación normal, (1): Leve pérdida de la aireación pulmonar, (2): Moderada pérdida de
la aireación pulmonar, (3) Severa pérdida de la aireación pulmonar. T0: sin distrés, T20:20 min. post distrés, T60: 60
min. post distrés, T120: 120 min. post distrés.
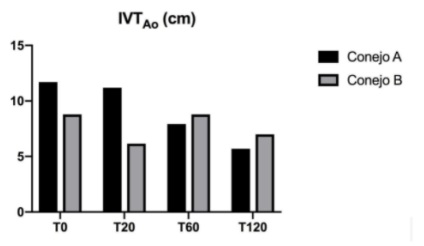
Figura 7: Evolución de los valores de IVTAo, FC y Distancia por minuto en los conejos A sin SDRA y B con SDRA.
T0: sin distrés, T20:20 min. post distrés, T60: 60 min. post distrés, T120: 120 min. post distrés.
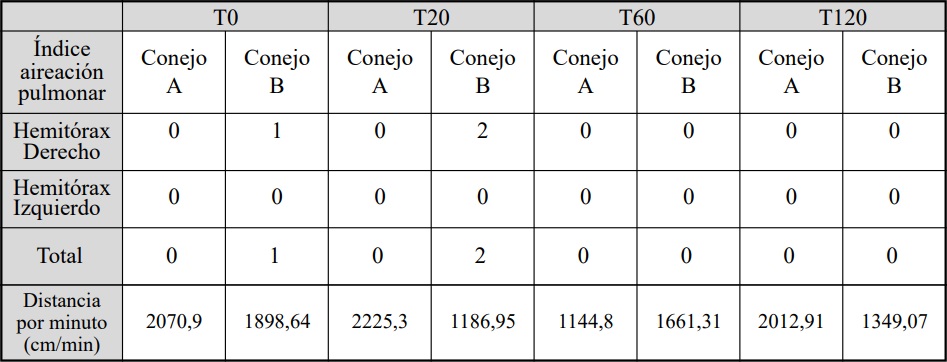
Tabla 4: Evolución de los valores de IVTAo de los conejos A sin SDRA y B con SDRA. T0: sin distrés, T20:20 min.
post distrés, T60: 60 min. post distrés, T120: 120 min. post distrés.
DISCUSIÓN
En este estudio se evaluó la capacidad de
un nuevo dispositivo ACRA, diseñado específicamente para proveer una ventilación simultánea,
protectiva e independiente a dos conejos con diferentes condiciones pulmonares.
La ventilación mecánica a más de un individuo con un único respirador ha sido propuesta
previamente por diferentes autores5, 17, 19, 27, quienes sugirieron que esta estrategia sólo debería
aplicarse en situaciones de crisis con escasez de
equipamiento. En contraposición otros investigadores reportaron dificultades en la ventilación
dual, dada la incapacidad de generar diferentes
presiones de trabajo a los pulmones ventilados simultáneamente y a la imposibilidad de lograr un
volumen corriente requerido para cada paciente4,23. Sin embargo, durante la pandemia actual de
COVID-19 y debido a la demanda mundial enorme
y sin precedentes de recursos hospitalarios disponibles, se han publicado un número creciente de
trabajos que presentan ideas novedosas, sugerencias y pautas de uso de esta técnica que superan
las limitaciones antes mencionadas1, 7-10, 20, 21, 26.
El dispositivo ACRA presentado en este
estudio, se basa en la restricción del flujo en el circuito inspiratorio, mediante el giro delicado de la
válvula restrictora de flujo. Este sistema permitió
realizar ajustes manuales estrictos en tiempo real
del flujo inspiratorio, siendo el mismo principio
sugerido actualmente por varios autores8-10, 20. La
interfaz permitió dividir la salida del respirador
en dos unidades ventiladas simultáneamente. Al
ser utilizado en un modo de ventilación controlado por presión, posibilitó la titulación selectiva e individual de PIP, PEEP y por lo tanto de DP,
además del VTe en el escenario propuesto, es
decir dos animales con condiciones pulmonares
diferentes (complacencia y resistencia), sin verse afectado el funcionamiento del respirador. Los
manómetros analógicos del ACRA permitieron un
seguimiento continuo e individualizado de PIP y
PEEP de cada animal de la dupla. La medición del
VTe de ambas unidades fue factible y su valor se
comparó con los datos obtenidos del monitor de
mecánica respiratoria.
Los valores registrados de gasometría arterial de los conejos ventilados simultáneamente
demostraron un incremento en los índices de intercambio gaseoso, luego del modelo de distrés
respiratorio. Esto refuerza la posibilidad de este
dispositivo de garantizar una ventilación protectiva individualizada. Es importante destacar que en
el animal que no presentaba el modelo de distrés
respiratorio agudo, las variables de intercambio
gaseoso no disminuyeron sino, por el contrario,
presentaron un incremento durante el tiempo de
ventilación dual. Asimismo, los valores de las variables respiratorias y hemodinámicas evaluadas
durante la ventilación dual (pre y post distrés), se
mantuvieron dentro del rango de normalidad para
la especie en condiciones de anestesia y ventilación mecánica.
Es interesante destacar que la complacencia dinámica se mantuvo en el mismo nivel durante toda la experiencia, en el animal B. Esto pudo
haber sido el producto de la implementación de
un nivel de PEEP mayor con respecto al conejo
A, desde el momento inicial. Mas aún el nivel de
PEEP en el conejo B, luego de ser distresado fue
mayor (entre 8 y 12 cm H2O) y pudo haber contribuido a evitar una caída mayor en la complacencia
dinámica. Adicionalmente es interesante destacar que en el animal A, no distresado, durante la
ventilación con el dispositivo ACRA se generó una
mejoría en la complacencia dinámica de corta duración ya que a partir del los 60 minutos comenzó
a evidenciarse una disminución en dicho parámetro. Esto podría justificarse pensando en el colapso pulmonar asociado a la ventilación mecánica.
Es importante remarcar que en ningún momento
se realizaron maniobras de reclutamiento o apertura pulmonar que podrían haber evitado esta situación. Si bien en el animal distresado no hubo
modificaciones en la complacencia luego de la maniobra de lavado, como se hubiera esperado, durante el mayor tiempo de la ventilación dual, cada
conejo tuvo valores de complacencia distintos, lo
cual garantizó el mantenimiento de condiciones
pulmonares diferentes.
Así como fue reportado anteriormente en
humanos y en conejos3, 14 la ultrasonografía pulmonar realizada durante la experiencia, posibilitó
sugerir en forma rápida la pérdida o ganancia de
la aireación pulmonar. En una situación como la
actual pandemia, donde las afecciones pulmonares
necesitan ser rápidamente categorizadas, la ultrasonografía pulmonar posibilita sugerir en forma
rápida la pérdida o ganancia de la aireación pulmonar11,25,30, 31. Es interesante destacar que esta modalidad de evaluación es libre de radiación hacia los
pacientes y puede, por lo tanto, ser repetida múltiples veces en la cabecera del mismo15. Sin embargo,
el sesgo de los resultados puede relacionarse con
la experiencia del operador o la variabilidad inter-operador. Es por ello que se recomienda la evaluación por un mismo operador formado.
La ultrasonografía, además, posibilitó
ampliar la monitorización hemodinámica a través
del IVTAo en los conejos, como fuera propuesto por
diferentes autores2, 6, 22, 24. El IVTAo es un índice importante de volumen sistólico. La multiplicación
de IVTAo por el área de la sección transversal del
anillo aórtico, es uno de los métodos más utilizados para calcular el volumen sistólico mediante
ecocardiografía. Como el tamaño de la raíz aórtica de un sujeto no cambia, la variación del flujo
sanguíneo aórtico se correlaciona directamente
con el cambio en el volumen sistólico13. Estudios
previos13,18 han demostrado una alta correlación
entre la variación de IVTAo, medida mediante ecocardiografía transtorácica, y la variabilidad del
volumen sistólico (VVS) en humanos28. Asimismo,
esta variable se ha empleado en caninos y humanos como un subrrogante del volumen sistólico2,6,24 o como una variable dinámica de respuesta
a la reposición de fluidos22. Adicionalmente, el IVTAo multiplicado por la FC, nos aporta el valor de
la “distancia por minuto”, que se relaciona directamente con el gasto cardíaco y ha sido un método
alternativo para evaluar modificaciones en el mismo cuando no se dispone de métodos invasivos6,24.
Nuestro estudio fue el primero que utilizó
una nueva interfaz preformada para ventilación
dual que permitió el control individualizado de la
PIP, PEEP, DP y por lo tanto del VTe en un modelo
de SDRA en animales vivos. La prueba del ACRA
en dos animales en dupla con diferentes mecánicas respiratorias, contribuyó al experimento con
respuestas biológicas y hemodinámicas en tiempo real durante la ventilación dual. Los resultados
obtenidos podrían servir como antecedentes prometedores para futuras investigaciones.
Este experimento presenta varias limitaciones. Primero, el ACRA no nos permitió controlar de forma independiente la frecuencia respiratoria y la relación I:E de los conejos ventilados
en dupla y, en nuestro estudio, todos los animales
recibieron la misma FiO2
. En segundo lugar, los
datos del respirador como única fuente de VTe requieren un análisis adicional para obtener valores
individuales. En tercer lugar, fue necesario administrar bloqueantes neuromusculares a los conejos para evitar respiraciones espontáneas que
pudiesen haber afectado a la ventilación del otro
animal. En cuarto lugar, nuestro experimento se
probó en un modelo animal vivo durante 2 horas
y se simularon escenarios limitados para probar
el rendimiento del dispositivo ACRA. Finalmente,
sólo se empleó una dupla de conejos siendo nuestros resultados de carácter preliminar. Por lo tanto, se requieren ensayos experimentales futuros,
con mayor número de animales, para obtener resultados concluyentes.
CONCLUSIONES
En el modelo experimental ensayado, la
división del flujo de salida del respirador, los ajustes de presión independientes y la administración
individual del volumen corriente fueron factibles,
a pesar de la heterogénea condición pulmonar de
los animales. La interposición del ACRA permitió
la ejecución de una ventilación pulmonar protectiva y la preservación del equilibrio hemodinámico
y respiratorio en los animales estudiados.
En conclusión, resulta evidente que la ventilación dual limita las capacidades de la ventilación
individual. Sin embargo, nuestro estudio demostró
que es posible controlar de forma independiente el
nivel de PIP, PEEP, DP y VTe a cada uno de los conejos ventilados de manera simultánea.
En una situación de pandemia en la que
la escasez de respiradores puede empeorar los resultados de salud de la población mundial, esta es
una alternativa que podría ser considerada.
BIBLIOGRAFÍA
1. Beitler, J. R.; Kallet, R.; Kacmarek, R.; et al. Ventilator
sharing protocol: Dual- patient ventilation with a single
mechanical ventilator for use during critical ventilator
shortages. Columbia University College of Physicians &
Surgeons and New York-Presbyterian Hospital. 2020. Available at: https://protocols.nyp.org/Documents/Ventilator_Sharing_Protocol.pdf. Accessed May 22, 2020.
2. Blanco, P. Rationale for using the velocity-time integral
and the minute distance for assessing the stroke volume
and cardiac output in point-of-care settings. Ultrasound J.
2020. 12(1), 1-9
3. Bouhemad, B.; Brisson, H.; Le-Guen, M.; et al. Bedside Ultrasound Assessment of Positive End-Expiratory Pressure-induced Lung Recruitment. Am J Respir Crit Care Med
2011; 183:341-7.
4. Branson, R.D.; Rubinson, L. A single ventilator for multiple simulated patients to meet disaster surge. Acad
Emerg Med. 2006;13(12):1352‐1354.
5. Branson, R.D.; Blakeman, T.C.; Robinson, B.R.; et al. Use of
a single ventilator to support 4 patients: Laboratory evaluation of a limited concept. Resp Care. 2012; 57:399–403.
6. Cattai, A.; Rabozzi, R.; Ferasin, H.; et al. Haemodynamic
changes during propofol induction in dogs: new findings
and approach of monitoring. BMC Vet Res. 2018; 14, 282.
7. Cherry, A.D.; Cappiello, J.; Bishawi, M.; et al. Shared ventilation: toward safer ventilator splitting in resource
emergencies. Anesthesiology. 2020; 133(3), 681-683.
doi:10.1097/ALN.0000000000003410
8. Clarke, A.L.; Stephens, A.F.; Liao, S.; et al. Coping with COVID-19: ventilator splitting with differential driving pressures using standard hospital equipment. Anaesthesia;
2020; 75(7), 872-880. doi:10.1111/anae.15078.
9. Han, J.S.; Mashari, A.; Singh, D.; et al. Personalized ventilation to multiple patients using a single ventilator. Crit
Care Explor. 2020; 2(5).
10. Herrmann, J.; Fonseca da Cruz, A.F.; Hawley, M.L.; et al. Shared ventilation in the era of COVID-19: A theoretical consideration of the dangers and potential solutions. Respir
Care. 2020; 65(7), 932-945.doi:10.4187/respcare.07919.
11. Huang, Y.; Wang, S.; Liu, Y.; et al. A Preliminary Study on
the Ultrasonic Manifestations of Peripulmonary Lesions
of Non-Critical Novel Coronavirus Pneumonia (COVID-19). BMC Med. 2020;
12. Lachmann, B.; Robertson, B.; Vogel, J. In vivo lung lavage
as an experimental model of the respiratory distress syndrome. Acta Anaesthesiol Scand.1980; 24:231–236.
13. Lewis, J.F.; Kuo, L.C.; Nelson, J.G.; et al. Pulsed Doppler
echocar- diographic determination of stroke volume
and cardiac out- put: clinical validation of two new
methods using the apical window. Circulation. 1984;
70:425–431.
14. Li, D. K.; Liu, D.M; W., Long, Y.; et al. Wang, X. T. Use of lung
ultrasound to assess the efficacy of an alveolar recruitment maneuver in rabbits with acute respiratory distress syndrome. Journal of Ultrasound in Medicine. 2015;
34(12), 2209-2215
15. Lichtenstein, D.; Mezière, G. Relevance of lung ultrasound
in the diagnosis of acute respiratory failure: the BLUE
protocol. Chest. 2008; 134:117-25.
16. Monastesse, A.; Girard, F.; Massicotte, N.; et al. Lung ultrasonography for the assessment of perioperative atelectasis: a pilot feasibility study. Anesthesia & Analgesia. 2017;
124(2): 494-504.
17. Neyman, G.; Irvin, C.B. A single ventilator for multiple simulated patients to meet disaster surge. Acad Emerg Med.
2006; 13:1246–9.
18. Nguyen, H.B.; Rivers, E.P.; Abrahamian, F.M.; et al. Severe sepsis and septic shock: review of the literature and
emergency department management guidelines. Ann
Emerg Med. 2006; 48:28–54.
19. Paladino, L.; Silverberg, M.; Charchaflieh J.G.; et al. Increasing ventilator surge capacity in disasters: Ventilation of
four adult-human-sized sheep on a single ventilator with
a modified circuit. Resuscitation 2008; 77:121–126.
20. Raredon, M.S.B.; Fisher, C.; Heerdt, P.; et al. Pressure-Regulated ventilator splitting (PReVentS): A COVID-19
response paradigm from Yale University. MedRxiv 2020;
doi: 2020.04.03.20052217 (Accessed May 22, 2020).
21. Roy, S.; Bunting, L.; Stahl, S.; Textor, D. Inline positive
end-expiratory pressure valves: the essential component
of individualized split ventilator circuits. Critical Care Explorations. 2020; 2(9).
22. Slama, M.; Masson, H.; Teboul, J.; et al. Respiratory variations of aortic VTI: a new index of hypovolemia and fluid
responsiveness. Am J Physiol Heart Circ Physiol. 2002;
283:1729–33.
23. Society of Critical Care Medicine, American Association for
Respiratory Care, American Society of Anesthesiologists,
Anesthesia Patient Safety Foundation, American Association of Critical-Care Nurses, and American College of Chest
Physicians: Joint statement on multiple patients per ventilator. 2020. Available at: https://www.sccm.org/COVID19RapidResources/Resources/Consensus-Statement-on-Multiple-Patients-Per-Venti (Accessed May 22, 2020)
24. Sohn, S.; Kim, H.S.; Han, J.J. Doppler flow velocity measurement to assess changes in Inotropy and Afterload: a study
in healthy dogs. Echocardiography. 2002; 19:207–13.
25. Soldati, G.; Smargiassi, A.; Inchingolo, R.; et al. Is there a
role for lung ultrasound during the COVID-19 pandemic?
2020. JUM doi: 10.1002/jum.15284.
26. Solis-Lemus, J.A.; Costar, E.; Doorly, D.; et al. A simulated single ventilator / dual patient ventilation strategy
for acute respiratory distress syndrome during the COVID-19 pandemic. R. Soc. Open Sci. 2020; 7: 200585.
27. Sommer, D.D.; Fisher, J.A.; Ramcharan, V.; et al. Improvised
automatic lung ventilation for unanticipated emergencies. Crit Care Med. 1994; 22:705-709.
28. Thomas, D.E.; Yousef, Z.R.; Fraser, A.G. A critical comparison of echocardiographic measurements used for optimizing cardiac resynchronization therapy: stroke distance
is best. Eur J Heart Fail. 2009; 11:779–88.
29. U.S Food and Drug Administration: Emergency Use Authorization for Ventilators, anesthesia gas machines modified for use as ventilators, and positive pressure breathing devices modified for use as ventilators (collectively
referred to as “ventilators”), ventilator tubing connectors,
and ventilator accessories. Available at: https://www.fda.
gov/media/136437/download (Accessed May 22, 2020).
30. Volpicelli, G.; Mussa, A.; Garofalo, G.; et al. Bedside lung
ultrasound in the assessment of alveolar-interstitial syndrome. Am J Emerg Med. 2006; 24:689–96.
31. Volpicelli, G.; Lamorte, A.; Vilen, T. What’s new in lung ultrasound during the COVID-19 pandemic. Intensive Care
Med. 2020; 46(7), 1445-1448. doi:10.1007/s00134-
020-06048










