ARTÍCULO DE INVESTIGACIÓN
Efecto de la adición de L-carnitina y piruvato sobre la funcionalidad del espermatozoide equino criopreservado
Olmos Acevedo, R.1 ; Caldevilla, M.2,3 ; Bruno, S.4 ; Miragaya, M.2,3
1Hospital Veterinario Central del Ejército del Perú.
2Universidad de Buenos Aires, Facultad de Ciencias Veterinarias, Instituto de Investigación y Tecnología en Reproducción Animal (INITRA).
3Universidad de Buenos Aires, Facultad de Ciencias Veterinarias,Cátedra de Teriogenología.
4Haras Militar General Lavalle. Dirección de Remonta y Veterinaria
Recibido: 18/08/2020
Aceptado: 21/12/2020
Correspondencia e-mail: Mariana Caldevilla marianacaldevilla@gmail.com
Resumen
La criopreservación de semen equino representa una herramienta importante para mejorar el manejo reproductivo, sin embargo, el uso de semen equino congelado es aún limitado debido a la escasa tolerancia de los espermatozoides equinos a los procesos de congelación y descongelación. El objetivo del presente estudio fue evaluar el efecto de la adición de L-carnitina y piruvato de sodio al medio de congelamiento, sobre los parámetros espermáticos y la tasa de preñez. Se adicionó L-carnitina y piruvato de sodio al medio de congelamiento y se congeló con una curva rápida. Las muestras fueron descongeladas y evaluadas para movilidad espermática, viabilidad, morfología, funcionalidad de la membrana e integridad del acrosoma. Para evaluar la tasa de preñez se inseminaron 20 yeguas. Se observó que la adición de L-carnitina y piruvato en el semen equino no mejoró los resultados de movilidad progresiva ni demás parámetros cinemáticos. El porcentaje de espermatozoides con acrosoma/HOS positivo, el porcentaje de espermatozoides vivos con acrosoma intacto y el porcentaje de espermatozoides normales fueron significativamente mayores en las muestras con L-carnitina y piruvato. Por otro lado, no se observaron mejoras en la tasa de preñez en comparación a la obtenida usando el semen del grupo control pos-descongelado.
Palabras clave: L-carnitina, Piruvato, Congelamiento, Semen, Equino
Effect of the addition of L-carnitine and pyruvate on the functionality of cryopreserved equine sperm
Summary
Cryopreservation of equine semen represents an important tool to improve reproductive management, however the use of frozen equine semen is still limited due to the poor tolerance of equine sperm to freezing and thawing processes. The aim of the present study was to evaluate the effect of the addition of L-carnitine and sodium pyruvate to the freezing medium on sperm parameters and pregnancy rates. L-carnitine and sodium pyruvate were added to the freezing medium of the treatment group and cryopreservation was performed with a rapid freezing curve. The samples were thawed and evaluated for sperm mobility, viability, morphology, membrane functionality, and acrosome integrity. To assess pregnancy rates, 20 mares were inseminated. In the results it was observed that the addition of L-carnitine and pyruvate in the post-thawed equine semen did not improve the results in terms of progressive motility and other kinetic parameters. The percentage of acrosome / HOS positive, the percentage of live sperm with intact acrosome, and the percentage of normal sperm were significantly higher in the L-carnitine and pyruvate samples. On the other hand, no improvements in the pregnancy rate were observed compared to that obtained using the semen of the post-thawed control group.
Key words: L-carnitine, Pyruvate, Freezing, Semen, Equine.
Introducción
La criopreservación se usa para almacenar de manera permanente ovocitos, embriones, espermatozoides y tejidos gonadales, tanto en humanos como animales28.El semen congelado permite la disponibilidad continua de semen, alcanzar momentos óptimos para la inseminación, disminuir el riesgo de transmisión de enfermedades venéreas y permite generar bancos de material genético27. Sin embargo, el uso de semen congelado equino es aún limitado, debido a la escasa tolerancia de los espermatozoides equinos a los procesos de congelación y descongelación2 . El congelamiento profundo puede causar daños bioquímicos y funcionales en el espermatozoide, con reducción de la movilidad, viabilidad y transporte en el tracto genital femenino15. El uso de L-carnitina podría aminorar estos daños debido a un mecanismo antioxidante y/o antiinflamatorio, sugiriendo un papel protector contra la infertilidad masculina1 . La carnitina es una amina cuaternaria que se sintetiza en el hígado a partir de los aminoácidos lisina y metionina19. El piruvato es el producto final de la degradación de la glucosa en la glucólisis y es el sustrato del ciclo de Krebs, principal ruta de la formación de energía bioquímica de las células en forma de ATP y de poder reductor en forma de NADH. En ese sentido, se ha demostrado que la suplementación con L-carnitina asociada a piruvato permite mejorar la movilidad, viabilidad y evita la peroxidación lipídica del semen equino durante su almacenamiento a temperatura ambiente12. Visto el potencial de la L-carnitina y el piruvato de actuar en el metabolismo espermático y como aún no se conoce el efecto que podría tener sobre el semen equino congelado, el objetivo de este trabajo fue evaluar el efecto de la adición de L-carnitina y piruvato de sodio al medio de congelamiento, sobre los parámetros espermáticos del semen equino congelado-descongelado y en la tasa de preñez por inseminación artificial.
Materiales y métodos
Recolección y evaluación de semen
Se emplearon cuatro padrillos (n=4), cuyas edades estaban comprendidas entre los 7 y 11 años pertenecientes a las razas Holsteiner, Silla Holandés y Silla Argentino alojados en el Haras “General Lavalle”, ubicado en Tandil, provincia de Buenos Aires. Estos padrillos tenían fertilidad probada, no recibieron tratamientos ni padecían lesiones o patologías y se encontraban en condiciones de D.S.O. (Daily Sperm Output) al momento de la extracción de semen. Se recolectaron cinco eyaculados (r=5) de cada macho utilizando una vagina artificial modelo Missouri y un súcubo natural. El eyaculado se evaluó macro y microscópicamente previo al procesamiento. La movilidad espermática del semen fresco se evaluó de manera subjetiva por observación directa sobre platina termostatizada (37 ºC) y la concentración espermática se evaluó mediante hemocitometría utilizando una cámara de Neubauer. Se evaluó morfología, viabilidad, funcionalidad de la membrana y evaluación de la integridad del acrosoma. Cada eyaculado se diluyó volumen: volumen en diluyente de Kenney (2,4 g de leche descremada, 4,9 g de glucosa, antibiótico 1 g de ticarcilina, 100 ml agua destilada estéril), se dividió en 2 alícuotas, se centrifugó 15 minutos a 800 g, se aspiró el sobrenadante y el pellet fue rediluido con los siguientes diluyentes: 1) diluyente base: 50 % de lactosa al 11 %, 25 % EDTA-glucosa, 0,5 % Equex, 20% de yema de huevo, 5% de dimetilformamida; 2) diluyente base con el agregado de L-carnitina (50 mM) y piruvato de sodio (10 mM). El semen diluido se equilibró 30 minutos a temperatura ambiente (22 a 26 ºC), luego se envasó en pajuelas de 0,5 ml. Las pajuelas fueron colocadas en gobeletes plásticos y sumergidos en una mezcla de etanol-acetona 1:1 dentro de un canastillo de bronce. El congelamiento se realizó de acuerdo a un protocolo usado para semen equino en 20016, 17,20. Brevemente, el canastillo fue mantenido dentro del termo de nitrógeno (de 10 litros) a 6 cm por encima del nivel del nitrógeno líquido, controlando el descenso de la temperatura con un termómetro digital desde temperatura ambiente hasta – 15 ºC (descenso de 10-12 ºC/minuto). Luego se llevó el canastillo hasta el nivel del nitrógeno líquido, hasta alcanzar los – 120 ºC (descenso de 25 a 40 ºC/minuto), se sacaron las pajuelas de la mezcla de etanol-acetona y finalmente se sumergieron en el nitrógeno líquido, a – 196 ºC.
El descongelamiento se realizó en baño térmico a 37 ºC durante 1 minuto.
Evaluación de los parámetros cinemáticos
Se evaluaron los parámetros cinemáticos utilizando un sistema computarizado el ISAS v1 (Proiser®, Valencia, España). Las muestras de semen fueron colocadas en una cámara ISAS D4C temperada a 37 °C. Se analizaron los siguientes parámetros cinemáticos: movilidad no progresiva (%), movilidad progresiva (%), estáticos (%), velocidad curvilínea (μm/seg), velocidad en línea recta (μm/seg), velocidad de trayectoria media (μm/seg), amplitud del desplazamiento lateral de la cabeza (μm), frecuencia de bateo espermático (Hertz), índice de oscilación (en %) rectitud (%) y linealidad (%).
Evaluación de la funcionalidad de la membrana e integridad del acrosoma
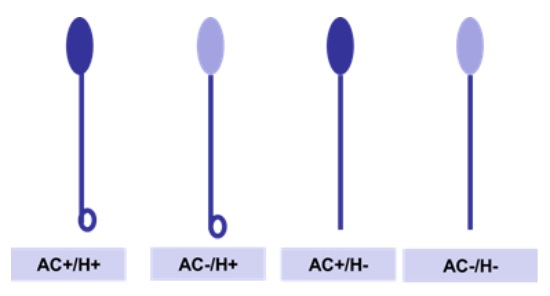
Se evaluaron espermatozoides equinos mediante la tinción con Azul de Coomassie (AC) en muestras sometidas previamente a una prueba hipoosmótica (AC/HOS) con la finalidad de evaluar simultáneamente el estado acrosomal y la funcionalidad de la membrana espermática10. Brevemente, se incubó el semen a 37 ºC durante 10 minutos en una solución de lactosa 50 mosm21. Se rediluyó en paraformaldehído al 2 % a temperatura ambiente durante 4 minutos. Se centrifugó dos veces más a 3000 rpm durante 3 minutos y se rediluyó en PBS. Se colocó una gota de la muestra en el portaobjetos y se tiñó durante 5 minutos con el colorante AC. Se observó con microscopio óptico con objetivo de inmersión, contando 200 espermatozoides por muestra. Los cuatro patrones observados fueron espermatozoide con acrosoma y test hipoosmótico positivo (AC+/H+), espermatozoide sin acrosoma y test hipoosmótico positivo (AC-/H+), espermatozoide con acrosoma y test hipoosmótico negativo (AC+/H-) y espermatozoide sin acrosoma y test hipoosmótico negativo (AC-/H-) (Figura 1).
Figura 1. Esquema de los patrones de espermatozoides teñidos con Azul de Coomassie y host test.
Evaluación de la viabilidad espermática
Se evaluaron espermatozoides equinos mediante el uso de la triple tinción14.Se mezclaron dos gotas de igual volumen de semen y azul de tripán sobre un portaobjetos se homogeiniza y se realiza un extendido secándolo al aire. Luego se tiñó con rojo fenol por dos minutos, se lavó y se tiñó con Giemsa durante 15 minutos. Las muestras se observaron con objetivo de inmersión (1000x), contando 200 espermatozoides por muestra. Los seis patrones observados fueron: espermatozoide vivo con acrosoma intacto (V/AI), espermatozoide vivo con acrosoma dañado (V/AD), espermatozoide vivo con acrosoma perdido (V/A), espermatozoide muerto con acrosoma intacto (M /AI), espermatozoide muerto con acrosoma dañado (M /AD), espermatozoide muerto con acrosoma perdido (M /AP) (Figura 2).
Figura 2. Esquema de los patrones de espermatozoides teñidos con la triple tinción.
Evaluación de la morfología espermática
Las muestras se fijaron en solución bufferada formolada al 12,5 % y se evaluaron por observación directa entre porta y cubreobjetos utilizando un microscopio de contraste de fase a 1000x 18, clasificando a los espermatozoides en tres categorías según la presencia o no de anormalidades: a) normal, b) anormalidades primarias y c) anormalidades secundarias.
Inseminación artificial
Se seleccionaron 20 yeguas de la raza Silla Argentino tipo Salto y Adiestramiento alojadas en las instalaciones del mismo haras, de edades entre 3 y 12 años, se inseminaron 10 yeguas con el diluyente base y 10 yeguas con diluyente base con el agregado de L-carnitina y piruvato de sodio. El ciclo estral se sincronizó administrando una dosis de 250 ug de cloprostenol (DL-Ciclase®, Sintex) por vía intramuscular. Ante la presencia de un folículo mayor a 35 mm se administró 1 ml (1 mg/ml) de deslorelina por vía intramuscular (BET Pharm, Kentucky, USA). El seguimiento folicular por vía ecográfica se efectuó cada 6 horas hasta la detección de la ovulación. Se realizó la inseminación intrauterina profunda en la punta del cuerno ipsilateral a la ovulación utilizando una dosis de 60 x 106 espermatozoides con movilidad progresiva. La inseminación se realizó con un catéter flexible de 75 cm de largo colocado por vía transcervical y guiado por manipulación transrectal y un estilete para descargar el contenido de la pajuela. El diagnóstico de gestación se realizó por ultrasonografía transrectal a los 14 días pos-ovulación.
Análisis estadístico
Los datos fueron analizados con un diseño factorial, con un factor que es la presencia del antioxidante, con 2 niveles con y sin L-carnitina y piruvato, bloqueando por macho. Se realizó un análisis de varianza mientras que en los parámetros que no demostraron normalidad se realizó un análisis de Kruskal Wallis. Las variables que se analizaron mediante un análisis de Kruskal Wallis fueron el porcentaje de espermatozoides normales en la evaluación de la morfología, dentro de los patrones de tinción de HOS/AC el porcentaje de espermatozoides HOS positivo sin acrosoma presente y en el uso de la triple tinción fueron el porcentaje de espermatozoides muertos con acrosoma intacto y el porcentaje de espermatozoides muertos con acrosoma perdido. La diferencia entre los porcentajes de preñez obtenidos se estimó utilizando un análisis de chi-cuadrado. Los datos se expresan en valores medios ± desvío estándar (DS), y se consideró un nivel de significancia del 5 %.
Resultados
Parámetros cinemáticos del semen descongelado
En las muestras de semen equino pos-descongelado el porcentaje de espermatozoides móviles no progresivos fue significativamente mayor (p<0,05) en las muestras adicionadas con L-carnitina y piruvato respecto al control. No se observaron diferencias significativas (p> 0,05) en el resto de los parámetros cinemáticos evaluados (Tabla 1).
Funcionalidad de la membrana y evaluación del acrosoma
El porcentaje de espermatozoides con acrosoma y test de HOS positivo fueron significativamente mayores (p<0,05) para las muestras con L-carnitina y piruvato con respecto al grupo control. Por otro lado, no se encontraron diferencias significativas (p>0,05) al comparar ambos grupos para los demás patrones (Tabla 2).
Viabilidad espermática e integridad acrosomal
En las muestras de semen pos-descongelado los porcentajes de espermatozoides vivos con acrosoma intacto fueron significativamente mayores (p<0,05) en el grupo tratamiento respecto al control. No se observaron diferencias significativas (p>0,05) en el porcentaje de espermatozoides viables con acrosoma dañado o perdido, ni en el porcentaje de espermatozoides muertos con acrosoma intacto, dañado o perdido, al comparar las muestras de semen del grupo tratamiento y el control (Tabla 3).
Morfología espermática
En las muestras de semen pos-descongelado el porcentaje de espermatozoides normales fueron significativamente mayores (p<0,05) en el medio con el agregado de L-carnitina y piruvato respecto al control. Por otro lado, no se observaron diferencias significativas (p>0,05) con respecto a la presencia de anormalidades primarias ni en el porcentaje de anormalidades secundarias entre ambos grupos (Tabla 4).
Porcentaje de preñez
No se observaron diferencias significativas (p>0,05) en cuanto al porcentaje de preñez alcanzados empleando semen de uno solo de los padrillos, entre el grupo control y el grupo tratamiento, observando un 50 % de preñez en cada uno de los dos grupos.
Tabla 1. Evaluación mediante un sistema computarizado de análisis de semen (CASA; el ISAS v1 Proiser®, Valencia, España) de los parámetros cinemáticos del semen equino pos-descongelado. Los datos son porcentajes promedio ± DS.
a,b letras diferentes indican diferencias significativas
ALH amplitud del desplazamiento lateral de la cabeza
BCF: frecuencia de bateo espermático
LIN: linealidad
STR: rectitud
VCL: velocidad curvilínea
VSL: velocidad en línea recta
VAP: velocidad de trayectoria media
WOB: índice de oscilación
Tabla 2. Determinación de la funcionalidad de la membrana y evaluación del acrosoma mediante la prueba hipoósmotica y azul de Coomassie en el semen equino pos-descongelado. Los datos son porcentajes promedio ± DS.
a,b letras diferentes indican diferencias significativas
AC+ / H+: espermatozoide con acrosoma, test hipoosmótico positivo
AC- / H+: espermatozoide sin acrosoma, test hipoosmótico positivo
AC+ / H-: espermatozoide con acrosoma, test hipoosmótico negativo
AC- / H-: espermatozoide sin acrosoma, test hipoosmótico negativo
Tabla 3. Evaluación de la viabilidad espermática e integridad del acrosoma del semen equino pos-descongelado. Los datos son porcentajes promedio ± DS.
a,b letras diferentes indican diferencias significativas
V/AI : Espermatozoide vivo con acrosoma intacto
V/AD: Espermatozoide vivo con acrosoma dañado
V/A: Espermatozoide vivo con acrosoma perdido
M /AI: Espermatozoide muerto con acrosoma intacto
M /AD: Espermatozoide muerto con acrosoma dañado
M /AP: Espermatozoide muerto con acrosoma perdido
Tabla 4. Evaluación de la morfología espermática del semen equino pos-descongelado. Los datos son porcentajes promedio ± DS.
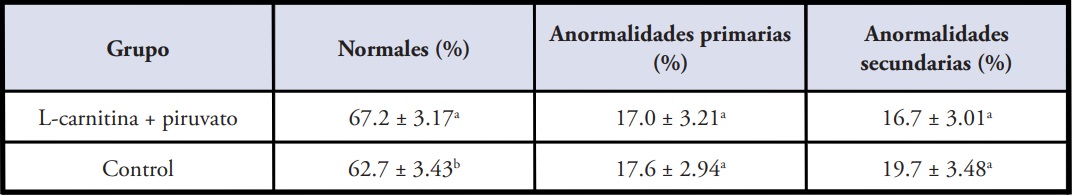
Dentro de cada columna, diferente superíndice (a, b) indica diferencia significativa (p<0.05).
Discusión
Existe una gran variabilidad individual de los padrillos en cuanto a la supervivencia de los espermatozoides después del proceso de congelación-descongelación3 quien observó que sólo el 30% de un grupo de padrillos producía semen que conservaba una buena movilidad después de la congelación con regularidad. Los cambios que se producen en la membrana espermática durante el proceso de enfriamiento son críticos para mantener la integridad de la membrana plasmática y pueden afectar la viabilidad de los espermatozoides congelados-descongelados11. La adición de antioxidantes a los medios de congelación según los estudios publicados aumenta la calidad de los espermatozoides después de la descongelación y el rendimiento reproductivo después de la inseminación artificial13. Estudios realizados en espermatozoides humanos26 reportaron que la adición de 100 mM de L-carnitina a las muestras de semen redujo la tasa de apoptosis y produjo un incremento significativo en la movilidad espermática. En búfalos, la suplementación del diluyente de congelamiento con L-carnitina (0,05 mg/ml) mejoró la movilidad pos-descongelamiento, el índice de viabilidad, la integridad acrosomal, la fertilización in vitro y las tasas de concepción7 . En otras especies también se han demostrado los efectos benéficos de la adición de L-carnitina sobre la preservación seminal y la integridad del ADN, como en el caso de los estudios realizados en semen de conejo8 . La L-carnitina (25 mM) mejoró la movilidad de espermatozoides epididimarios de gato tras el proceso de congelamiento16. También se han reportado mejoras en la calidad seminal de gallos tras la adición de L-carnitina en los diluyentes de congelamiento9 y un incremento en el porcentaje de espermatozoides vivos sin peroxidación lipídica, con disminución de la susceptibilidad de ADN a la fragmentación22. En el presente estudio se observó un efecto beneficioso de la adición de L-carnitina y piruvato en ciertos parámetros espermáticos. Se encontraron valores superiores respecto al control, en el porcentaje de espermatozoides con acrosoma funcional/test de HOS positivo y en el porcentaje de espermatozoides viables/acrosoma intacto. Sin embargo, esto no se hizo evidente en la evaluación de la movilidad progresiva. En el presente estudio se alcanzaron tasas de preñez del 50% usando semen con y sin L-carnitina y piruvato. Estos resultados coinciden con otros reportes24, pero son menores que las tasas de preñez alcanzadas 68,9%20y 76%23 en estudios que emplearon curvas rápidas de congelamiento. Por otro lado, una posible explicación de la tasa de preñez obtenida en el presente estudio podría deberse a la dosis inseminante empleada25 (60 x 106 espermatozoides), ya que fue menor a la recomendada de 150 x 106 espermatozoides23 con movilidad progresiva. De esta manera, a pesar de haberse encontrado algún efecto beneficioso en la adición de L-carnitina y piruvato a las muestras de semen este efecto no se vio reflejado en la tasa de preñez obtenida. El éxito de un programa de IA requiere un adecuado manejo y habilidad en la maniobra de inseminación, preparación de la yegua5 , manejo del padrillo, la fertilidad inherente a cada uno de ellos29, el manejo de las muestras de semen colectado, que son muy susceptibles a sufrir daño o alteraciones en sus características normales, etc.4 ; cualquiera de los factores mencionados pueden haber afectado los resultados del procedimiento.
Conclusiones
Teniendo en cuenta los resultados obtenidos, podemos decir que la adición de L-carnitina y piruvato en el diluyente de congelamiento del semen equino no mejoró la movilidad espermática progresiva pos-descongelado; sin embargo se observó una mejoría en la funcionalidad de la membrana, acrosoma, viabilidad y morfología espermática. Dado los resultados de la presente investigación, si bien no se logró aumentar la tasa de preñez, se requieren desarrollar más estudios con la adición de L-carnitina y el piruvato al semen equino para comprobar su efecto sobre la tasa de preñez en un número mayor de yeguas, mayor número de padrillos, así como también utilizando mayor número de espermatozoides por dosis.
1. Abd-Allah, A. R.; Helal, G. K.; Al-Yahya, A. A.; Aleisa, A. M., Al-Rejaie, S. S.; Al-Bakheet, S. A. Pro-inflammatory and oxidative stress pathways which compromise sperm motility and survival may be altered by L-carnitine. Oxidative medicine and cellular longevity 2009; 2:73-81.
2. Ball, B.A.; Vo, A. Osmotic tolerance of equine spermatozoa and the effects of soluble cryoprotectants on equine sperm motility, viability, and mitochondrial membrane potential. Journal of andrology 2001; 22:1061–1069.
3. Boyle, M.S. Artificial insemination in horses. Annales de zootechnie 1992; 41: 311-318.
4. Brinsko, S.P., Varner, D.D. Artificial Insemination and Preservation of Semen. Veterinary Clinics of North America: Equine Practice 1992; 8(1), 205–218.
5. Curnow, E. M. Artificial insemination and mare management. Equine Veterinary Education 1993; 5(1), 10- 13.
6. Cristanelli, M.J.; Squires, E.L.; Amann, R.P.; Pickett, B.W. Fertility of stallion semen processed, frozen and thawed by a new procedure. Theriogenology 1984; 22 (1): 39-45.
7. El-Raey, M.; Badr, M.R.; Assi, M.M.; Rawash, Z.M. L-carnitine enhancing roles on buffalo semen freezability, Ultra structure and fertilizing potentials. Assiut Veterinary Medical Journal 2016; 62 (149): 163-173.
8. El-Nattat, W.S.; El-Sheshtawy, R.I.; Mohamed, A.A. Effect of L-Carnitine on Semen Characteristics of Chilled Rabbit Semen. Global Journal of Biotechnology & Biochemistry 2011; 6 (1): 08-12.
9. Fattah, A.; Sharafi, M.; Masoudi, R.; Shahverdi, A.; Esmaeili, V.; Najafi, A. L-carnitine in rooster semen cryopreservation: flow cytometric, biochemical and motion findings for frozen-thawed sperm. Cryobiology 2016; 74: 148-153.
10. Ferrante A.; Caldevilla M.; Miragaya M. Combinación de la tinción azul de Coomassie con la prueba hipoosmótica para evaluar espermatozoides equinos y porcinos. Invet 2017; 19 (1): 66.
11. Garcia, V. C., Oliveira, P. V.; Campos, G. A.; Caneiro, J. A.; Andrade, L. R.; Silva, L. C.; et al. Alternative cooling curves for stallion semen cryopreservation. Journal of Equine Veterinary Science 2016; 43: S66- S67.
12. Gibb, Z.; Lambourne, S.R.; Quadrelli, J.; Smith, N.D.; Aitken, R.J. L-carnitine and pyruvate are prosurvival factors during the storage of stallion spermatozoa at room Temperature. Biology of Reproduction 2015; 93(4):104, 1–9.
13. Großfeld R.: Sieg B.; Struckmann C.; Frenzel A.; Maxwell W.; Rath D. New aspects of boar semen freezing strategies. Theriogenology 2008; 70:1225–1233.
14. Kovacs, A.; Foote, R.H. Viability and Acrosome staining of bull and rabbit spermatozoa. Biotechnic & histochemistry 1992; 67: 119-124.
15. Leboeuf B.; Restall B.; Salamon S. Production and storage of goat semen for artificial insemination, Animal Reproduction Science 2000; 62: 113–141.
16. Manee-in S, Parmornsupornvichit S, Kraiprayoon T, Tharasanit P, Hanapiwat O, Kaeokey K. L-carnitine supplemented extender improves cryopreserved- thawed cat epididymal sperm motility. Asian Australas Journal of Animal Science 2014; 27(6): 791-796.
17. Martin, J.C.; Klug, E.; Gunzel, A. Centrifugation of stallion semen and its storage in large volume straws. Journal of Reproduction and Fertility 1979; 27:47-51.
18. Mc Kinnon A., Squires E., Vaala W., Varner D. Equine Reproduction, 2nd edition. Wiley- Blackwell, 2011. Capítulo 126 Spermatozoal morphology, pág. 1297 y capítulo 128 Breeding with cooled transported semen, pag.1316.
19. Meadows, J.A.; Wargo, M.J. Carnitine in bacterial physiology and metabolism. Microbiology 2015; 161: 1161–1174.
20. Miragaya M.H.; Chaves M.G.; Neild, D.M.; Beretta, C.; Agüero, A. Artificial insemination using semen cryopreserved with a simple manual method. In: Proc. Third International Symposium on Stallions Reproduction, January 10-12, Fort Collins, Colorado, USA. / Fertility and Sterility. 2001; 68: 336-337.
21. Neild D.; Chaves G.; Flores M.; Mora N.; Beconi M.: Aguero A. Hypoosmotic test in equine spermatozoa. Theriogenology 1998; 51:721-727.
22. Partyka, A.; Rodak, O.; Bajzert, J.; Kochan, J.; Wojciech, N. The Effect of L-carnitine, hypotaurine, and aurine supplementation on the quality of cryopreserved chicken semen. BioMed Research International 2017; Volume 2017, 8 p.
23. Pugliesi, G., Furst, R., Carvalho, G.R. Impact of using a fast-freezing technique and different thawing protocols on viability and fertility of frozen equine spermatozoa. Andrologia 2014; 46(9), 1055-1062.
24. Rigby, S.L., Derczo, S., Brinsko, S., Blanchard, T., Taylor, T., Forrest, D.W., Varner, D. Oviductal sperm numbers following proximal uterine horn or uterine body insemination. Proceedings of the American Association of Equine Practitioners 2000; 46, 332-334.
25. Rigby SL, Lindsey AC, Brinsko SP, Blanchard TL, Love CC, Varner DD. Pregnancy rates in mares following hysteroscopic or rectally-guided utero-tubal insemination with low sperm numbers. In: Proceedings of 3rd International Symposium on Stallion Reprodection, Fort Collins, CO; 2001; 49.
26. Sanchez R.; Gomez, I.; Samper, J.C. Artificial Insemination with Frozen Semen (capítulo 15). Equine breeding management and artificial insemination. Samper JC, ed. Elsevier Health Sciences. 2da ed. USA 2009; 175-183.
27. Shahrzad, E.; Zahiri, S.; Ghasemi, F.; Jahromi, H.K. A Study of effects of L-carnitine on morphology and apoptosis in cryopreserved sperm. Advances in Environmental Biology 2013; 7(9): 2126-2134.
28. Shaw, J.M.; Jones, G.M. Terminology associated with vitrification and other cryopreservation procedures for oocytes and embryos. Human Reproduction Update 2003; 9 (6): 583-605.
29. Sieme, H., Schafer, T., Stout, T.A.E., Klug, E., Waberski, D. The effects of different insemination regimes on fertility in mares. Theriogenology 2003; 60: 1153–1164