ARTÍCULO DE INVESTIGACIÓN
Inmunolocalización de la integrina A5B1, la laminina y el colágeno tipo v en placenta porcina en diferentes etapas gestacionales.
Vélez, CL1,2; Williamson, DM1 ; Clauzure, M1,2; Koncurat, MA1 ; Barbeito, CG2,3 .
1 Facultad de Ciencias Veterinarias – UNLPam.
2 CONICET
3Laboratorio de Histología y Embriología Descriptiva, Experimental y Comparada. Facultad de Ciencias Veterinarias – UNLP.
Recibido: 15/08/2019
Aceptado: 23/12/2019
Correspondencia e-mail: Claudio G. Barbeito barbeito8@hotmail.com
Resumen
Las moléculas de adhesión son indispensables para el anclaje y la adhesión de los epitelios materno y fetal en la placentación porcina. El objetivo fue determinar la inmunolocalización de la integrina α5β1, la laminina y el colágeno V, en placentas porcinas de diferentes períodos de gestación: 30, 60, 70 y 114 días de gestación (dg; n=23). Se determinó la inmunolocalización de las moléculas por inmunohistoquímica. La integrina α5β1 fue fuerte en el tejido conectivo del endometrio y alrededor de vasos sanguíneos en placenta materna y fetal. La laminina se identificó en la interfase fetomaterna porcina, a los 30, 60 y 114 dg de forma leve; en cambio, la intensidad de marcación fue fuerte en estroma endometrial, glándulas endometriales, en los vasos sanguíneos y en la membrana basal de las vellosidades a lo largo de toda la gestación. El colágeno V se evidenció con una fuerte intensidad en el mesénquima de las vellosidades placentarias maternas, y alrededor de los vasos sanguíneos en placenta fetal y materna. En base a nuestros resultados, postulamos que la integrina α5β1, la laminina y el colágeno tipo V, podrían cumplir un rol crucial en el desarrollo y el mantenimiento de la arquitectura placentaria y angiogénesis.
Palabras clave: Integrinas; Laminina; Colágeno; Gestación porcina.
Immunolocalization of integrin A5B1, laminin and type v collagen in porcine placenta in different gestational stages.
Summary
Adhesion molecules are essential for anchoring and adhesion during swine placentation in both the maternal and the fetal epithelia. The aim of this work was to determine the expression of α5β1 integrin and its receptors, laminin and collagen type V, in swine placentas at different gestation intervals: 30, 60, 70 and 114 days of gestation (dg; n = 23). The expression of these molecules was determined by immunohistochemistry. Here we found that the α5β1 integrin was expressed at high levels in endometrial connective tissue and around blood vessels of the maternal and fetal placenta. Laminin was expressed in the swine fetal-maternal interface, at 30, 60 and 114 dg in a mild manner. On the other hand, the expression was strong in endometrial stroma, endometrial glands, blood vessels and basal membrane of the villi throughout pregnancy. Collagen type V was strongly expressed in the mesenchyme villi of the maternal placenta and around the fetal and maternal placenta vessels.
Based on our results, we postulate that α5β1 integrin, and its receptors, could play a crucial role in the development and maintenance of placental architecture and angiogenesis.
Key words: Integrin; Laminin; Collagen; Porcine gestation.
Introducción
La placenta porcina cumple sus funciones a través de la adhesión entre las membranas fetales y el endometrio, permitiendo el intercambio fisiológico entre el feto y la madre. En cerdos, debido a su placentación epiteliocorial29, existen procesos de remodelación en diferentes momentos de la gestación19, que se complementan con cambios en los perfiles de citoquinas24. Estas modificaciones nos permiten postular que las moléculas de adhesión de la interfase feto-materna, pueden modificarse en el transcurso de la preñez. Dentro de estas moléculas de adhesión, las integrinas intervienen en la adhesión célula a célula y conectan la matriz extracelular con el citoesqueleto de la célula. A través de esta interacción, participan en la adhesión, la migración, la invasión tisular y el control de la fisiología celular, transmitiendo señales de activación metabólica. Conforman una familia de proteínas heterodiméricas que son receptores transmembrana, catión-dependientes, compuestas de dos subunidades: α y β3 .
Diversos estudios sobre la implantación embrionaria en diferentes especies mostraron la participación de las integrinas en los acontecimientos involucrados en la implantación1,2,8,10,12,16. Se detectaron integrinas en los sitios de fijación durante la implantación temprana en humanos14, murinos30y porcinos2,11. En la mujer, se considera a las integrinas como probables marcadores de la receptividad uterina para la implantación del embrión, cuando el útero se encuentra bajo la influencia de la progesterona5 . Hanashi et al.9 , demostraron que la subunidad de integrina β1 participa en la fase final de la implantación en la decidua humana. La integrina α5β1posee un rol crucial en la implantación de murinos21 , bovinos16 y porcinos18 . Sin embargo, no se han hallado estudios de la expresión de la integrina α5β1 en la placenta porcina en los períodos posteriores a la implantación.
Los principales ligandos de las integrinas incluyen un gran número de proteínas extracelulares de la matriz, como la fibronectina, la laminina y el colágeno tipo V12. En el cerdo, se ha estudiado el papel de las integrinas y de sus ligandos de la matriz extracelular (MEC), comparando su expresión en útero no gestante con una preñez temprana a los 10-15 días2, 3; pero no se realizaron estudios en estadios más avanzados de la preñez. Este trabajo tiene como objetivo determinar la inmunolocalización de la integrina α5β1, la laminina y el colágeno tipo V, en placentas porcinas de diferentes períodos de gestación.
Materiales y métodos
Se utilizaron 23 tractos reproductivos de cerdas destinadas a faena, entre segundo y tercer parto, mestizas (Landrace x Large White) con períodos gestacionales entre los 30 y 114 días de gestación (dg) y 8 úteros de cerdas no gestantes (NG). Los tractos se obtuvieron de frigoríficos de la zona de General Pico, provincia de La Pampa, Argentina (35° 45´ y 63° 50´ de latitud y longitud, respectivamente), excepto 8 muestras placentarias de cerdas a término que se tomaron en criaderos de la misma zona, durante el parto. Todos los animales se encontraban en buen estado de salud con plan sanitario completo.
Los tractos reproductivos gestantes (n=23) se obtuvieron de cerdas de 30 dg (n=7), 60 dg (n=4), 70 dg (n=4) y 114 dg (n=8). Se determinó la edad gestacional de acuerdo al promedio de la longitud céfalo-caudal de los embriones/fetos según la tabla desarrollada por Marrable17. La elección de los días de gestación estudiados estuvo en relación a que en ellos se producen procesos determinantes para una gestación exitosa. A los 30 dg comienza la osificación y el desarrollo del sistema inmunológico4 . En el período de 60 dg se alcanza el mayor crecimiento placentario y se terminan de formar las vellosidades secundarias y terciarias de la interfase feto-materna7 . A los 70 dg las placentas inician un estado de meseta en su desarrollo y los fetos comienzan a crecer de manera exponencial, y además, se observa la mayor remodelación placentaria celular7 . El período a término (114 dg), se escogió porque indica el fin de los mecanismos moleculares involucrados en el mantenimiento de la gestación. Los cuernos uterinos se incidieron por la curvatura mayor. Se recogieron muestras de placenta y úteros no gestantes (NG); que se fijaron en formol bufferado al 10%. Las placentas de 114 dg, fueron obtenidas en el momento del parto. Las muestras fueron procesadas para su inclusión en parafina. Algunos cortes se colorearon con la técnica convencional de la Hematoxilina-Eosina15 y otros fueron procesados para inmunohistoquímica.
Determinación de integrinas y sus ligandos
Se determinó la inmunolocalización de la integrina α5β1 y sus ligandos laminina y colágeno V utilizando la técnica de inmunohistoquímica indirecta detallada en el trabajo de Vélez23 por inmunoperoxidasa con Diaminobencidina como cromógeno. Para la integrina α5β1: se utilizó un anticuerpo de ratón monoclonal, MAB1969 (Chemicon, USA), dilución 1:1500. Para laminina se utilizó un anticuerpo de conejo policlonal (ab11575; Abcam, USA), dilución 1:500; y para colágeno V se utilizó un anticuerpo de ratón monoclonal (NBP1-05118; Novus Biologicals, USA), dilución 1:300. A las muestras se las incubó 20 horas a 4°C. Se utilizó como control positivo cortes de piel de ratón. El control negativo se trató igual que las muestras, sólo que se reemplazó el anticuerpo primario por PBS. Los resultados de las técnicas inmunohistoquímicas se observaron en un microscopio Axiophot (Carl Zeiss, Alemania) montado con una cámara Canon PowerShot G20 (Tokio, Japón). Se tomaron microfotografías (n=20) a 400X, de cada estructura estudiada (epitelio luminal endometrial, trofoblasto, glándulas y tejido conectivo). La intensidad de marcación de las integrinas y sus ligandos se expresó en forma semicuantitativa como: (-)negativo, (+)leve, (++)moderada y (+++)fuerte.
Resultados
Integrina α5β1
Los resultados de la intensidad de inmunomarcación de la integrina α5β1en diferentes periodos de gestación se detallan en la Tabla I y se pueden observar en la Figura 1.
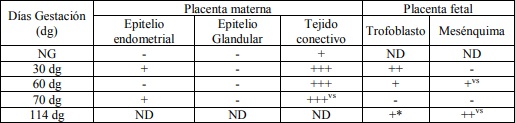
Tabla I:Expresión de la integrina α5β1 sobre diferentes estructuras de la placenta materna y la placenta fetal; en útero no gestante y de diferentes periodos de gestación. NG: útero no gestante. ND: no determinado. +, ++, +++: Diferentes grados de positividad. -: Negativo. *: Coloración en porción apical del trofoblasto. vs: inmunomarcación alrededor de vasos sanguíneos.
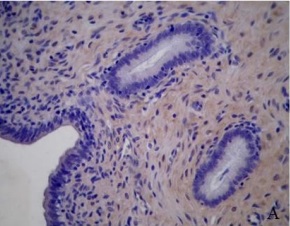
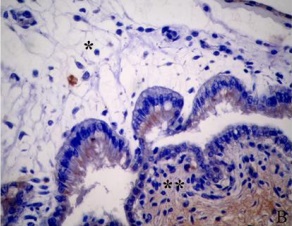
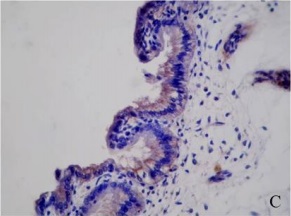
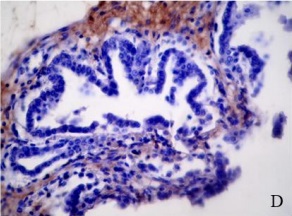
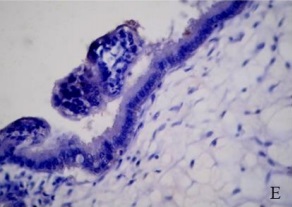
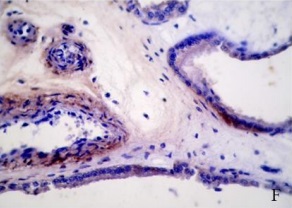
Figura 1.Expresión de integrina α5ß1 en la placenta porcina
Laminina
Los resultados de la intensidad de inmunomarcación de laminina en diferentes periodos de gestación, se detallan en la Tabla II y se pueden observar en la Figura 2.
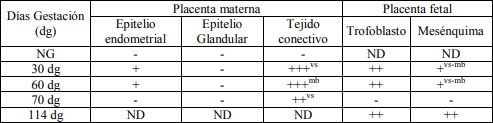
Tabla II: Expresión de laminina sobre diferentes estructuras en placenta materna y fetal; en útero no gestante y de diferentes periodos de gestación.
NG: útero no gestante. +, ++, +++: diferentes grados de positividad. -: Negativo. ND: no determinado. vs: vasos sanguíneos. mb: membrana basal.
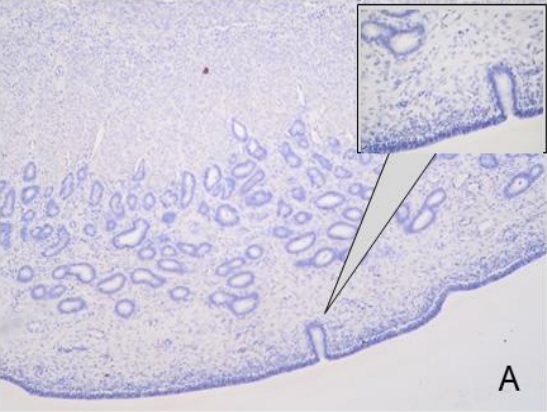
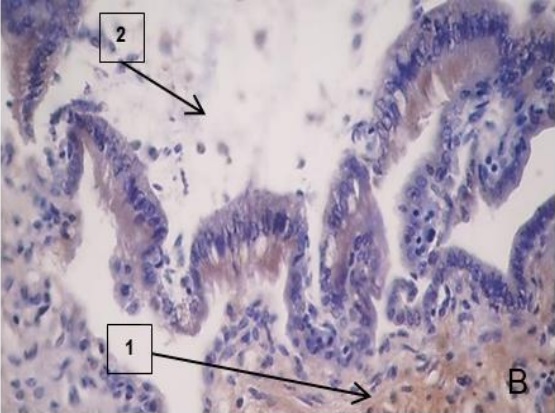
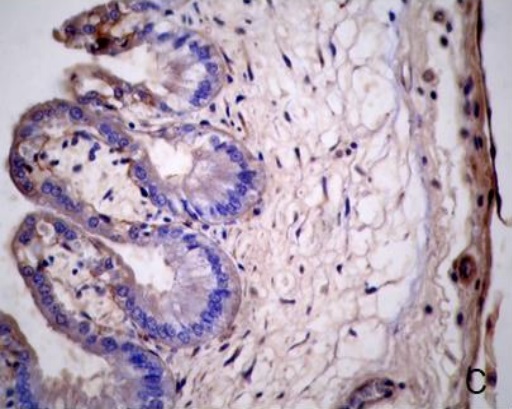
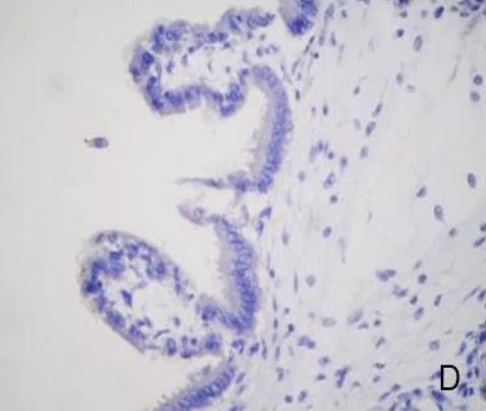
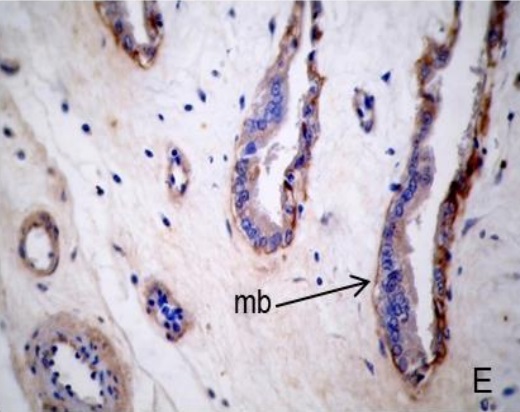
Figura 2.Expresión de laminina en la placenta porcina
Colágeno V
Los resultados de la intensidad de inmunomarcación del colágeno V en diferentes periodos de gestación, se detallan en la Tabla III y se pueden observar en la Figura 3.
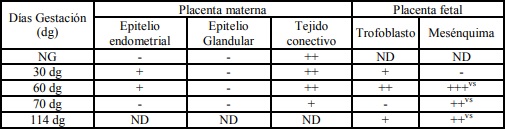
Tabla III: Expresión de laminina sobre diferentes estructuras en placenta materna y fetal; en útero no gestante y de diferentes periodos de gestación.
NG: útero no gestante. +, ++, +++: diferentes grados de positividad. -: Negativo. ND: no determinado. vs: vasos sanguíneos. mb: membrana basal.
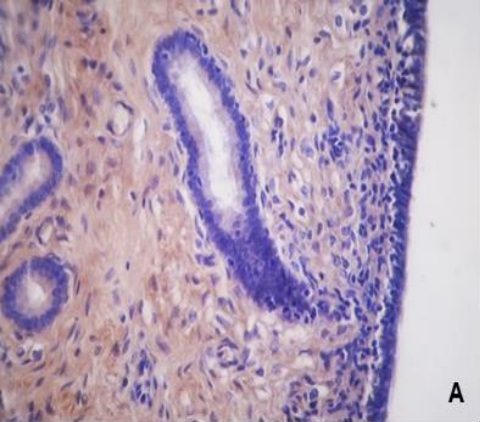
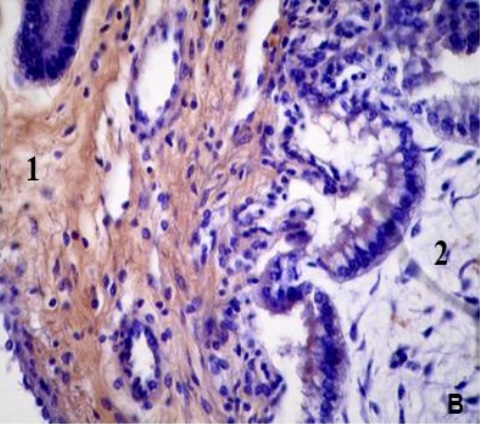
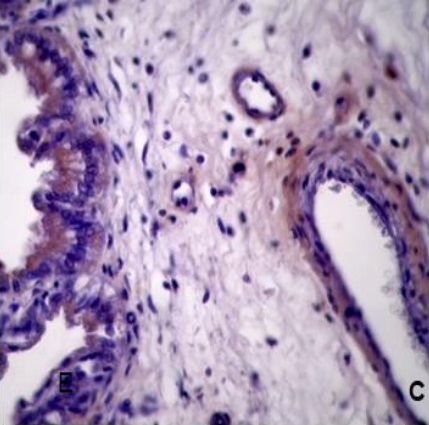
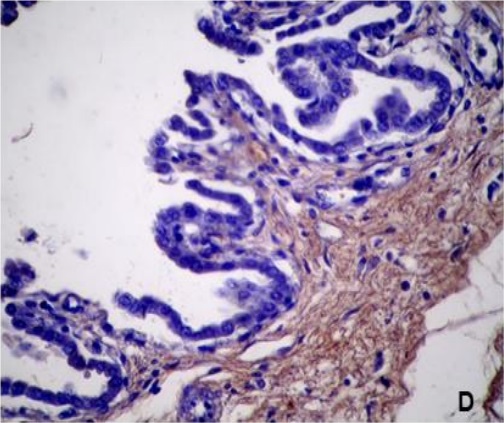
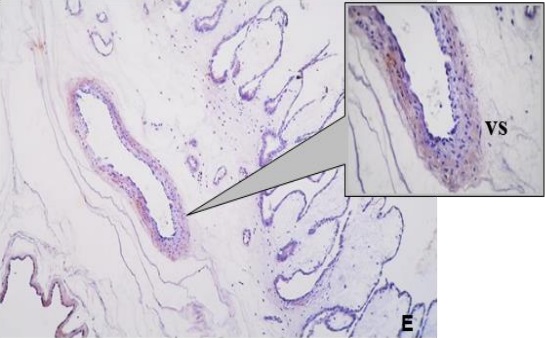
Figura 3. Expresión de colágeno V en la placenta porcina
DISCUSIÓN
Este trabajo se realizó con el fin de aportar conocimientos acerca de la fisiología molecular reproductiva porcina. Para que la gestación progrese, es necesario que se establezca una interacción entre el conceptus y el endometrio, que involucra, entre otras moléculas, a las integrinas y sus ligandos, que serían responsables del reconocimiento y anclaje de los epitelios materno y fetal en la interfase placentaria porcina26,25. En trabajos anteriores postulamos que la integrina αvβ3, participaría en el desarrollo de la arquitectura de la interfase feto-materna junto a su ligando, la fibronectina25,22; debido a que hallamos estas moléculas fuertemente inmunomarcadas en ambos epitelios luminales en diferentes períodos de gestación.
Estudios realizados en porcinos durante la preñez temprana por Rashev et al.18, demostraron que la expresión de α5β1 fue elevada en trofoectodermo, superficie epitelial del endometrio uterino y glándulas endometriales, disminuyendo levemente a los 35 días. La integrina α5β1 es un receptor promiscuo, tanto de fibronectina y fibrinógeno como de colágeno, que participa en la formación de la arquitectura tisular, la vasculogénesis y la angiogénesis8,12. Coincidente con el estudio de Rashev et al 18, hemos hallado que la integrina α5β1 se presenta con mayor intensidad en la interfase placentaria, a los 30 dg; tanto en la placenta materna como en la fetal. Sin embargo no ha sido evidenciada la expresión de la integrina α5β1 en la interfase feto-materna (IFM) durante la gestación porcina en los períodos posteriores a la implantación. En el presente trabajo se observó que, la integrina α5β1 disminuyó, tanto en su intensidad de marcación como en su extensión, en los epitelios que conforman la interfase, a partir de los 60 dg hasta el período a término. Probablemente se deba a que a partir de los 70 dg la placenta cesa su crecimiento para permitir el aumento de peso de los fetos28. Sin embargo, esta molécula se detectó intensamente en el tejido conectivo del endometrio y alrededor de vasos sanguíneos tanto en la placenta materna como en la fetal, lo que indicaría su posible participación en la angiogénesis en estas etapas de la placentación.
La laminina es el principal componente de la lámina basal, se la ha observado en las membranas basales de las vellosidades de placentas humanas a término20. Estudios realizados en placenta humana y murina en gestación temprana13, demostraron que el rol principal de la laminina es el de adhesión de las células epiteliales a la lámina basal, ya que se presenta en el estroma decidual y en la lámina basal de las vellosidades placentarias, en el cordón umbilical, en las glándulas endometriales y en los vasos sanguíneos. Cristofolini et al.6 observaron neovascularización en gestaciones avanzadas, que estaría relacionada con el máximo crecimiento placentario entre los días 60 y 70, que permitiría un incremento de la superficie de intercambio y del flujo sanguíneo materno/fetal, para sostener la gran demanda metabólica de este período gestacional6. En este estudio determinamos la laminina en la IFM porcina, a los 30, 60 y 114 dg de forma leve. Además, en concordancia con los resultados de los autores mencionados, se evidenció una inmunomarcación fuerte en el estroma endometrial, en las glándulas endometriales, en los vasos sanguíneos y en la membrana basal de las vellosidades placentarias tanto maternas como fetales a lo largo de toda la gestación. De este modo la laminina participaría en la angiogénesis y en la adhesión de las células epiteliales de las vellosidades a la lámina basal. Estudios realizados en humanos sugieren que el colágeno V tendría un rol en la implantación, migración y mantenimiento de la interfase durante la gestación, al regular el correcto desarrollo de la matriz extracelular de la decidua10. Posiblemente, cumpla funciones similares en el porcino, debido a que se expresó intensamente en el mesénquima de las vellosidades placentarias maternas, y alrededor de los vasos sanguíneos en la placenta fetal y materna. Debido a esto observamos que en la especie porcina el colágeno V también cumple un rol en el mantenimiento de la MEC materna durante la gestación.
En base a nuestros resultados, la integrina α5β1, la laminina y el colágeno tipo V estarían cumpliendo un rol crucial en el desarrollo y mantenimiento de la arquitectura placentaria y angiogénesis.
En trabajos previos demostramos que las integrinas αvβ3, β1, α3 y β3 aumentan su expresión a los 5 días de gestación en el endometrio gestante27. Esto supone que la remodelación celular necesaria para el establecimiento y continuidad de la preñez porcina podría deberse a la influencia de los estrógenos, ya que previamente observamos que los picos de estrógenos séricos se correlacionan con la presencia de estas integrinas, tanto en el período de pre-implantación como en el de post-implantación. Debido a esto hallamos que la expresión de las integrinas estudiadas en el útero durante la gestación temprana porcina acompaña la presencia de los estrógenos, secretados principalmente por el componente placentario fetal22,27.
En base a nuestros resultados, postulamos que la integrina α5β1, la laminina y el colágeno tipo V, podrían cumplir un rol crucial en el desarrollo y el mantenimiento de la arquitectura placentaria y angiogénesis. Es necesario continuar con los estudios de las moléculas de adhesión y los ligandos que permitirían la construcción de la interfase feto-materna no invasiva de la especie porcina. Ya que son diversas las moléculas que estarían presentes, tomando un rol fundamental de adhesión y mantenimiento de la arquitectura placentaria, en los períodos donde las moléculas aquí estudiadas no se encuentran presentes, o su inmunomarcación es leve.
Bibliografía
1. Bazer, F.W.; Johnson, G.A. Pig blastocyst–uterine interactions. Differentiation. 2014;87:52–65.
2. Bowen, J.A.; Bazer, F.W.; Burghardt, R.C. Spatial and temporal analyses of integrin and Muc-1 expression in porcine uterine epithelium and trophectoderm in vivo. Biol Reprod. 1996;55(5):1098-106.
3. Bowen, J.A. and Hunt, J.S. The role of Integrins in Reproduction. Proc Soc Exp Biol Med, 2000;223:331-43.
4. Butler, J.E.; Lager, K.M.; Splichal, I.;et al. The piglet as a model for B cell and immune system development. Vet Immunol Immunopathol. 2009;128(1–3):147–70.
5. Carson, D.D.; Bagchi, I.; Dey, S.K.;et al. Embryo implantation. Dev Biol. 2000;223:217-37.
6. Cristofolini, A.; Fiorimanti, M.; Campos, M.; et al. Morphometric study of the porcine placental vascularization. Reprod Dom Anim.2018;53:217–25.
7. Cristofolini, A.; Sanchis, G.; Moliva, M.;et al. Cellular remodelling by apoptosis during porcine placentation. Reprod Dom Anim.2013; 48, 584–90.
8. Francis, S.E.; Goh, K.L.; Hodivala-dilke.K.;et al.Central roles of α5β1 Integrin and Fibronectin in Vascular Development in Mouse Embryos and Embryoid Bodies. Arter Thromb Vasc Biol. 2002;22:927–33.
9. Hanashi, H.; Shiokawa, S.; Akimoto, Y.;et al. Physiologic Role of decidual beta1 integrin and focal adhesion kinase in embryonic implantation. Endocr J. 2003;50(2):189-98.
10. Iwahashi, M.; Nakano, R. Decreased type V collagen expression in human decidual tissues of spontaneous abortion during early pregnancy. Clin Pathol. 1998;51:44–6.
11. Jaeger, L.A.; Johnson, G.A.; Ka, H.;et al.Functional analysis of autocrine and paracrine signaling at the uterine-conceptus interfacein pigs. Reprod Suppl. 2001; 58: 191-207.
12. Jimenez-Marín. Caracterización Molecular de las Integrinas Beta-1 (Cd29) y Beta-3 (Cd61) Porcinas. Obtención de Anticuerpos contra dominios específicos de ambas moléculas. Tesis doctoral. UNC. 2002.
13. Kaloglu, C.; Onarlioglu, B. Extracellular matrix remodelling in rat endometrium during early pregnancy : The role of fibronectin and laminin. Tissue Cell. 2010;42(5):301–06.
14. Kou, S.; Naoaki, K.; Shigetatsu, S.; Mamoru, T.; Toyohiko, M. Integrins and reproductive physiology: Expression and modulation in fertilization, embryogenesis, and implantation. Fertil Steril. 1997;67(5):799–811.
15. Luna, L. Manual of Histologic Staning Methods of the Armed Forces. New York. Toronto. McGraw-Hill. 1968. 40 p.
16. MacLaren, L.A.; Wildeman, A.G. Fibronectin receptors in preimplantation development: cloning, expression, and localization of the alpha 5 and beta 1 integrin subunits in bovine trophoblast. Biol Reprod. 1995;53(1):153–65.
17. Marrable, A.W. The Embryonic Pig: A Chronological Account. Ed. Pitman Medical Exe-ter. London. 1971.
18. Rashev, P.; Georgieva, D. Expression of α5β1 Integrin and Fibronectin during Early Pregnancy in Pigs. Folia Biologica(Praha) 2005;51:121-25.
19. Sanchis, E.G.;Cristofolini, A.L.;Fiorimanti, M.R.;Barbeito, C.G.;Merkis, C.I. Apoptosis and cell proliferation in porcine placental vascularization. Animal Reproduction Science.2017;184:20–28.
20. Shan, N.; Zhang, X.; Xiao, X.;et al. Laminin α4 (LAMA4) expression promotes trophoblast cell invasion, migration, and angiogenesis, and is lowered in preeclamptic placentas. Placenta. 2015;4:1–12.
21. Sutherland, A.E.; Calarco, P.G.; Damsky, C.H. Developmental regulation of integrin expression at the time of implantation in the mouse embryo. Development. 1993;119(4):1175–86.
22. Vélez, C.; Barbeito, C.; Koncurat, M. αvβ3 Integrin and fibronectin expressions and their relation to estrogen and progesterone during placentation in swine.Biotechnic & Histochemistry. 2018; 93:1, 15-24.
23. Vélez, C. Integrinas y su regulación por el sistema inmune durante la placentación porcina. Tesis Doctoral. Facultad de Ciencias Veterinarias, UNLP. 2017.
24. Vélez, C.; Barbeito, C.G.; Koncurat, M.A. IL-1β, IL-2 and IL-4 concentration during porcine gestation. Theriogenology. 2019;128:133-39.
25. Vélez, C.; Williamson, D.; Koncurat, M. Detection of fibronectin during porcine placentation. Arch Latinoam Prod Anim. 2014;22(1):31–36.
26. Williamson, D.M.; Koncurat, M.A. Expresión de la integrina αvß3 y de las subunidades de integrinas α3 y ß1 durante la placentación porcina. InVet. 2009;11(1):31-7.
27. Williamson, D.M.; Yaful, G.N.; Riesco, O.F.; Koncurat, M.A. Progesterona, Estrógenos y Expresión de Integrinas en la Gestación Temprana Porcina.Ciencia Veterinaria.2008;10(1):13-23.
28. Wilson, M.E.; Ford, S.P. Comparative aspects of placental efficiency. Reprod Suppl. 2001;(58):223-232.
29. Wooding, P.; Burton, G. Comparative Placentation: Structures, Functions and Evolution. Cambridge, United Kingdom, Ed. Springer, 2008, p. 105-14.
30. Wu, J.E.; Santoro, S.A. Complex patterns of expression suggest extensive roles for the alpha 2 beta 1 integrin in murine development. Dev Dyn. 1994;199(4):292-314.


















