ARTÍCULO DE INVESTIGACIÓN
Efectos del consumo de leche bubalina con alto contenido de grasas trans en la degeneración grasa hepática inducida por colesterol en conejos.
Lertora, W. J.1; Villordo, G. I.1; Mussart, N. B.2; Patiño, E. M.3; Montenegro, M. A.1; Cabrera, A. E.1; Sánchez Negrette, M.1
1Cátedra de Patología General y Sistemática.
2Hospital de Clínicas.
3Cátedra de Tecnología de los Alimentos. Facultad de Ciencias Veterinarias.Universidad Nacional del Nordeste.Corrientes. Argentina.
Recibido: 15/08/2018
Aceptado: 24/07/2019
Correspondencia e-mail: Walter Javier Lertora javierlertora@gmail.com
Resumen
Este trabajo comparó los efectos del consumo de dos leches bubalinas, con baja y alta relación de AGt/AGS, sobre la lipemia y el desarrollo de degeneración grasa hepática inducido por colesterol en conejos. Veinte conejos neozelandeses, machos, fueron aleatoriamente separados en un grupo control (n=10) que recibió leche con baja relación AGt/AGS (5,3% de AGt y 67,12 % de AGS) obtenida de búfalas en sistema pastoril; y un grupo alto trans (n=10) que recibió leche con alta relación AGt/AGS (25,84% de AGt y 45,89% de AGS) obtenida de búfalas con suplementación lipídica en su dieta. La leche fue administrada durante 75 días y su consumo fue registrado diariamente. A partir del día 15 todos los conejos recibieron 0,93 g de colesterol/día, vía oral, para inducir degeneración grasa hepática. Se evaluó el lipidograma sérico y los niveles de ALT y AST. En hígado se midió el contenido de lípidos y, en muestras histológicas, se evaluó el área sudanofílica, la fibrosis e infiltración de macrófagos. Los conejos consumieron 9293,13 ml y 9930 ml de leche con baja y alta relación AGt/AGS, respectivamente, sin diferencia entre grupos (p 0,404). El grupo alto trans registró mayores niveles séricos de colesterol total que el control (6,08 vs. 5,58 g/l, p 0,049). Los valores de ALT fueron significativamente (p <0,0001) mayores en el grupo alto trans. El hígado registró un significativo (p 0,0437) incremento de lípidos en el grupo alto trans (10,62 % de lípidos) cuando se comparó con el control (8,68 % de lípidos). El grupo alto trans registró en el parénquima hepático mayor extensión del área sudanofílica (37,05 % vs. 26,42 %, p 0,0338), mayor frecuencia de fibrosis (8 vs. 3 hígados, p 0,0247) y mayor infiltración de macrófagos (94,20 vs. 48 macrófagos, p 0,0190) que el grupo control. En conclusión, la leche con alta relación AGt/AGS contribuyó a incrementar la colesterolemia y a incrementar el efecto hepatotóxico del colesterol, cuando se comparó con la leche con baja relación de AGt/AGS. Dichos efectos estén, posiblemente, relacionados con el contenido de AGt de esta leche.
Palabras clave: Rumiante; Ácidos grasos trans; Conejo; Hígado graso.
Effects of trans fatty acid-enriched bubaline milk intake in hepatic fat degeneration induced by cholesterol in rabbits.
Summary
This work compared the effects of the two bubaline milk consumption, with low and high ratio of tFA/SFA, on lipemia and the development of hepatic fat degeneration induced by cholesterol in rabbits. Twenty New Zealand males rabbits were randomly separated into a control group (n=10) that received milk with low trans/saturated FA ratio (5.3% tFA and 67.12% SFA) obtained from grazing buffalos; and a high trans group (n=10) that received milk with high tFA/SFA ratio (25.84% tFA and 45.89% SFA) obtained from buffalos with lipid supplementation in their diet. The milk was administered for 75 days and its intake was recorded daily. From day 15, all rabbits were challenged with 0.93 g of cholesterol/day, orally, in order to induce hepatic fat degeneration. The serum lipidogram, ALT and AST were recorded. On the liver, lipid content, sudanophilic area, fibrosis and macrophage infiltration were evaluated. The rabbits voluntarily consumed 9293.13 ml and 9930 ml of milk with low and high tFA/SFA ratio, respectively, without difference between groups (p 0.404). Rabbits in high trans group registered higher serum levels of total cholesterol than the control group (6.08 vs. 5.58 g/l, p 0.049). The ALT were significantly (p <0.0001) higher in the high trans group than the control group. The liver lipids recorded a significant (p 0.0437) increase in the high trans group (10.62%) when it was compared to the control (8.68%).The high trans group recorded a greater extension of the sudanophilic area (37.05 ± 7.53% vs. 26.42 ± 12.55%, p 0.0338), a greater frequency of fibrosis (8 vs. 3 livers, p 0.0247) and more infiltration of macrophages in hepatic parenchyma (94.20 vs. 48 macrophages, p 0.0190) than the control group. In conclusion, milk with high tFA/SFA ratio contributed to increase total cholesterol levels and to increase the hepatotoxic effect of cholesterol, when was compared with milk with a low ratio of tFA/SFA. These effects are possibly related to the tFA content of this milk.
Key words: Ruminant; Trans fatty acids; Rabbi; Fatty liver.
Introducción
Mediante suplementación lipídica en la dieta de los rumiantes se puede reducir los ácidos grasos saturados (AGS) de cadena media e incrementar los ácidos grasos insaturados en la leche20; con efectos hipocolesterolémico y ateroprotector en el consumidor12, 16, 23. Estas estrategias de suplementación lipídica causan, invariablemente, incrementos de ácidos grasos trans (AGt) en la leche20. Un incremento sustancial de AGt en la leche puede contrarrestar el efecto saludable que se desea lograr con la reducción de AGS. Por ejemplo, una alta ingesta de AGt de origen rumiante (3,7% de la ingesta calórica diaria) causó hipercolesterolemia en humanos13. En conejos, una manteca con altos niveles de AGt (11,8% de trans-10 C18:1 y 1,8% de trans-11 18:1) y reducida en AGS (41,9%) causo hipercolesterolemia, incrementó las lipoproteínas de baja densidad y favoreció el desarrollo de ateroesclerosis2, 18. El efecto hepatotoxico de los AGt de origen rumiante ha sido menos documentado. Una grasa láctea enriquecida con trans-10 18:1 (20,24%) indujo degeneración vacuolar de hepatocitos, asociado a incrementos de triglicéridos y colesterol-LDL, en las ratas1. En cultivos de células de hepatoma humano (HepG2) desafiadas con trans-10 18:1, extraído del tejido adiposo de bovinos alimentados con granos, resultó ser más citotóxico que trans-9 18:1 (extraido de aceite parcialmente hidrogenado)24. Teniendo en cuenta los antecedentes reportados para algunos lácteos con alto contenido de AGt, este trabajo evaluó el efecto de dos leches bubalinas experimentales, con alta y baja relación AGt/AGS, sobre la lipemia y el desarrollo de degeneración grasa hepática inducida por colesterol en conejos. Nuestra elección del modelo biológico experimental se fundamentó en que el conejo hipercolesterolémico presenta un patrón lipoprotéico similar al humano hipercolesterolémico25. Además, este modelo presenta muchas de las características fisiopatológicas de la degeneración grasa hepática no alcohólica (NAFLD) del humano inducida por hiperlipidemia8, 15. Al igual que otras investigaciones, el conejo fue empleado para estudiar los efectos de la grasa láctea sobre la colesterolemia, perfil de lipoproteínas y metabolismo de lípidos en hígado2, 4, 18.
Materiales y métodos
Leche bubalina
(Tabla 1): Dos leches experimentales con diferente perfil de ácidos grasos fueron obtenidas de búfalas con y sin suplementación lipídica. La leche control presentó baja relación AGt/AGS (5,3 y 67,12 %, respectivamente) y fue obtenida de búfalas alimentadas con pastura natural y 2 Kg de maíz/día. La leche con alta relación AGt/AGS (25,84 y 45,89 %, respectivamente) fue obtenida de búfalas alimentadas con pastura natural y suplementadas diariamente con una mezcla de 210 ml de aceite de girasol + 90 ml de aceite de pescado vehiculizado en 2 kg de maíz durante 24 días. El contenido de colesterol (Laboratorio Físico-Químico, INTI, Buenos Aires) no difirió (prueba t bilateral para muestras independientes = p 0,727) entre la leche control (10,30 ± 2,27 mg/100g) y la leche con alta relación AGt/AGS (9,68 ± 2,55 mg/100g).
Tabla 1. Composición de ácidos grasos en leche de búfalas sin suplementación lipídica (leche control) y suplementadas con 300 ml/día de una mezcla (70:30 wt/wt) de aceite de girasol y de pescado durante 24 días (leche alta relación AGt/AGS)

* Prueba t bilateral para muestras independientes. ARA: ácido araquidonico. EPA: ácido eicosapentaenoico. DHA: ácido docosahexaenoico. AGS: ácidos grasos saturados. AGM: ácidos grasos monoinsaturados. AGP: ácidos grasos poliinsaturados. # La suma no incluye a cis-9,trans-11 18:2..
Animales, administración de leche y diseño experimental:
Veinte conejos machos Neozelandeses (proveídos por el Centro de Medicina Comparada, FCV-UNL, Esperanza, Santa Fe), con un peso corporal de 2,02 ± 0,25 kg, fueron divididos aleatoriamente en dos grupos de 10 animales, alojados en jaulas metálicas individuales, en una habitación con temperatura controlada (22ºC), con ciclo de luz/oscuridad de 12 horas y con acceso al agua de bebida y al alimento balanceado “ad libitum”. Los conejos recibieron leche control (grupo control) y leche alta relación AGt/AGS (grupo alto trans) durante 75 días. La leche fue administrada en forma fluida y su consumo fue voluntario; restringiendo su consumo diario a un máximo de 200 ml/conejo hasta el día 45 y a un máximo de 100 ml/conejo hasta el final de la experiencia. Durante los primeros 15 días de la experiencia se determinaron los efectos del consumo de las leches bubalinas sobre el lipidograma sérico y niveles de aspartato aminotransferasa y alanina aminotransferasa en conejos sin administración de colesterol. Durante los 60 días posteriores, se indujo hipercolesterolemia mediante la administración de colesterol vía oral (0,93g de colesterol 94%/conejo/día) y se determinó los efectos del consumo de las leches sobre el lipidograma sérico, niveles de transaminasas y degeneración grasa hepática en conejos con hipercolesterolemia. Se registro diariamente el consumo de leche y de alimento balanceado por animal. El peso corporal se registró semanalmente. Todos los procedimientos de este estudio fueron aprobados por el Comité de Ética y Bioseguridad, FCV-UNNE, protocolo Nº 017.
Extracción de sangre, lipidograma y enzimograma sérico:
La extracción de sangre se realizó los días 0, 15, 45 y 75 en todos los conejos con ayuno de 8 horas. Se determinaron triglicéridos (técnica del glicerolfosfato-oxidasa/peroxidasa, 505 nm, reactivos Wiener), colesterol total (colesterol-oxidasa-peroxidasa, 505 nm), colesterol ligado a lipoproteínas de alta densidad (C-HDL) y de baja densidad (C-LDL): precipitación selectiva de la lipoproteína y valoración enzimática de colesterol (reactivos Wiener). Como marcadores de daño hepático se determinó la actividad sérica de las enzimas aspartato aminotransferasa (AST-aspartato cetoglutarato) y alanina aminotransferasa (ALT-alanina cetoglutarato) lectura a 505 nm y reactivos de Wiener.
Necropsia y toma de muestras:
Cumplido los 75 días de la experiencia, se procedió a la eutanasia y necropsia de los animales. El hígado fue disecado, pesado y se tomaron muestras que fueron fijadas en formol bufferado al 10% durante 24 horas. Además, 15 gramos de hígado fue remitido para cuatificación de extracto etéreo (Laboratorio Tecnología de Alimentos, FCV-UNNE).
Histopatología del hígado:
Muestras previamente fijadas de hígado fueron congeladas, cortadas en criostato a 10 μm y coloreadas con Sudan IV para grasas. Las secciones de hígado teñidas con Sudan IV fueron fotografiadas (microscopio Carl Zeiss modelo Axio Scope A1 con camera digital AxiocamERc 5s) y las imágenes digitales fueron procesadas (software ImageJ) para medir el área de degeneración grasa, que fue expresado en porcentaje de sudanofilia que cubría un campo de 10x. Además, muestras formoladas de hígado fueron procesadas según la técnica histológica clásica para bloques parafinados, cortadas a 5 μm y teñidas con HE y tricrómica de Mallory para fibras colágenas. Basados en el sistema de estadificación de fibrosis hepática de Kleiner et al. (2005)9, la evolución de la fibrosis se clasificó en: 0 (ausente), 1a (delicada fibrosis perisinusoidal en zona centrolobulillar, requiere tinción tricromica para ser identificada), 1b (densa fibrosis perisinusoidal en zona centrolobulillar, visible facilmente con HE), 1c (fibrosis portal/periportal), 2 (fibrosis en zona centrolobulillar + portal/periportal), 3 (fibrosis en zona centrolobulillar + portal/periportal unidos por puentes de fibrosis) y 4 (cirrosis, fibrosis estadio 3 + nódulos de regeneración parenquimatosa + pérdida de la arquitectura). Cortes a 5 μm de bloques parafinados de hígado fueron montados en portaobjetos con poly-l-lisina para la marcación de macrófagos mediante inmunohistoquímica. Brevemente, los cortes fueron desparafinados en xilol e hidratados en concentraciones decrecientes de alcohol. La peroxidasa endógena se inactivó durante la hidratación con una solución de peróxido de hidrógeno al 3% en metanol durante 10 minutos. Posteriormente, los cortes fueron incubados con anticuerpo monoclonal de ratón anti-macrófagos de conejos (clon RAM11, dilución 1:200; Dako) durante 12 horas a 4ºC. Posteriormente, los cortes fueron incubados con anticuerpo policlonal anti-Ig G de ratón conjugado con biotina (Código AM-B1, dilución 1:200; ISAL-CONICET) durante 30 minutos a 25ºC, seguido de incubación con extravidina-peroxidasa (ExtraAvidin®-Peroxidase; Sigma-Aldrich) durante 30 minutos a 25ºC. Como cromógeno se empleó diaminobenzidina al 0,05% diluido en buffer fosfato salino con H2O2 al 0,015%; durante 10 minutos. Entre cada paso, los cortes fueron lavados con buffer fosfato salino 0,01 M, pH 7,2. En cada hígado se registró manualmente el número de macrófagos en 6 campos representativos con objetivo de 40x.
Análisis estadístico:
Los resultados fueron expresados en media ± desvió estándar (±DE). Con la prueba t para muestras independientes se comparó las medias del peso corporal, peso del hígado, consumo de alimento, consumo de leche y contenido de lípidos en hígado. Para asociar fibrosis al tipo de leche se realizó una tabla de contingencia. Se realizó un análisis de modelos lineales mixtos para comparar las medias de las variables del lipidograma sérico (colesterol total, C-HDL, C-LDL y triglicéridos) y comparar media y estudiar el efecto del tiempo en las variables del enzimograma (ALT y AST). Las diferencias entre los grupos fueron declaradas significativas con p ≤ 0,05.
Resultados
Consumo de leche, de alimento balanceado y peso corporal:
Todos los conejos aceptaron de forma voluntaria ambos tipos de leche. A lo largo de la experiencia, cada conejo consumió 9293,13 ± 1770,74 ml de leche bubalina control y 9930 ± 1557,88 ml de leche con alta relación AGt/AGS, no registrándose diferencias entre grupos (p 0,404). No difirió (p 0,486) el consumo diario de alimento del grupo control (77,19 ± 26,74 g/día) y del grupo alto trans (69,25 ± 34,80 g/día). Los conejos ganaron peso a lo largo de la experiencia, sin diferencias (p 0,892) entre los grupos control (1,08 ± 0,27 kg) y alto trans (1,10 ± 0,32 kg).
Lipidograma sérico:
Los conejos que consumieron leche con alta relación AGt/AGS registraron un leve incremento del colesterol total (6,08 ± 3,68 g/l) cuando se comparó con el grupo control (5,58 ± 3,47 g/l), dicha diferencia fue significativa (p 0,049). El colesterol LDL no registró diferencias (p 0,073) entre los grupos alto trans (4,10 ± 2,79 g/l) y control (3,64 ± 2,70 g/l). No se detectaron diferencias (p 0,078) en los registros del colesterol HDL entre los grupos alto trans (2,13 ± 1,31 g/l) y control (1,90 ± 1,26 g/l). Tampoco se detectaron diferencias (p 0,174) en la trigliceridemia de los grupos alto trans (1,97 ± 2,14 g/l) y control (1,29 ± 1,70 g/l). Cuando se evaluó el lipidograma sérico en los días 15, 45 y 75, las tasas séricas de colesterol total, colesterol HDL, colesterol LDL y triglicéridos no registraron diferencias significativas (p> 0,05) entre grupos.
Niveles séricos de transaminasas
(Tabla 2): Los conejos que consumieron leche con alta relación AGt/AGS registraron un incremento significativo (p <0,0001) en la tasa sérica de ALT en los días 15, 45 y 75 de la experiencia. El grupo control mantuvo estable los niveles séricos de ALT hasta el día 45; al final de la experiencia (día 75) registró un incremento en la tasa sérica de ALT, aunque significativamente inferior al grupo alto trans. La tasa sérica de AST no registró diferencias entre grupos (p 0,310) a lo largo de la experiencia.
Tabla 2. Comparación de la tasa sérica de ALT y AST, según grupo y tiempo
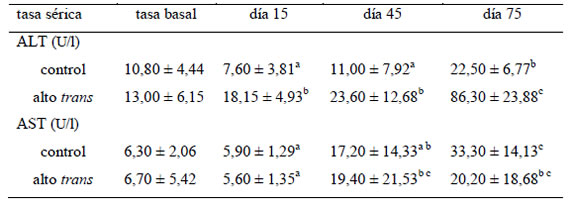
a,b,c,d: Medias con una letra común no son significativamente diferentes. ALT: alanina aminotransferasa, AST: aspartato aminotransferasa.
Contenido de lípidos en hígado e histopatología hepática
(Tabla 3): El contenido de extracto etéreo en hígado (10,62 ± 2,39 %) de los conejos que consumieron leche con alta relación AGt/AGS se incrementó significativamente (p 0,0437), cuando se comparó con el grupo control (8,68 ± 1,50 %). En todos los animales la degeneración grasa hepática fue microvesicular y predominó en los hepatocitos alrededor de la vena central (zona centrolobulillar) (Figuras 1c y 1d). El área sudanofílica del parénquima hepático (37,05 ± 7,53%) de los conejos del grupo alto trans (Figura 1b) fue significativamente mayor (p 0,0338), cuando se comparó con el grupo control (26,42 ± 12,55 % de área sudanofílica, Figura 1a). El grupo alto trans registró un significativo (p 0,0190) incremento de macrófagos (94,20 ± 50,68 macrófagos/6 campos de 40x), con respecto al control (48 ± 16,14 macrófagos/6 campos de 40x, Figura 1g). Los macrófagos se encontraron, principalmente, infiltrando el parénquima alrededor de la vena central (Figura 1h); localización en donde la degeneración grasa de hepatocitos fue más evidente.
Tabla 3. Efectos de leches bubalinas con baja (grupo control) y alta relación AGt/AGS (grupo alto trans) sobre el peso, contenido de lípidos, área sudanofílica, fibrosis y recuento de macrófagos en hígados de conejos hipercolesterolémicos. 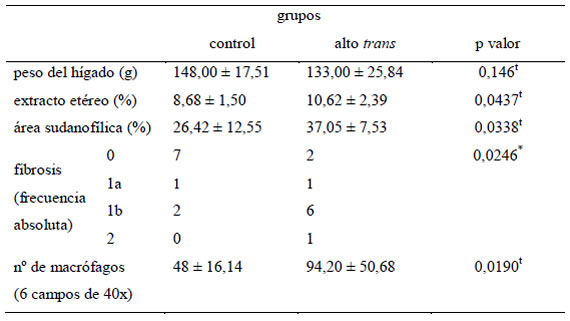
t: prueba t bilateral para muestras independientes. *: Chi cuadrado Pearson. 0 (fibrosis ausente), 1a (fibrosis perisinusoidal en zona centrolobulillar visible con tricromica), 1b (fibrosis perisinusoidal en zona centrolobulillar visible con HE), 2 (fibrosis en zona 3 + portal/periportal).
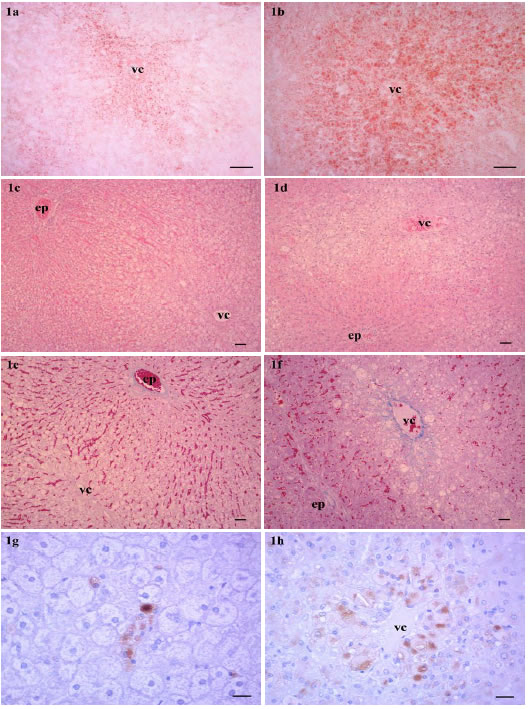
Figura 1. Degeneración grasa hepática inducida por colesterol en conejos que recibieron leche bubalina con baja relación AGt/AGS (a, c, e y g: grupo control) y alta relación AGt/AGS (b, d, f y h: grupo alto trans). 1a: Degeneración grasa microvacuolar centrolobulillar. 1b: Degeneración grasa microvacuolar panlobulillar (Sudan IV, barra: 100 μm). 1c: Degeneración grasa microvacuolar, más evidente en zona centrolobulillar. 1d: Degeneración grasa de hepatocitos con fibrosis perisinusoidal en zona centrolobulillar (H-E, barra: 50 μm). 1e: Estadio de fibrosis 0 (ausente). 1f: Fibrosis perisinusoidal en zona centrolobulillar (Tricrómica de Mallory, barra: 50 μm). 1g: Inmunomarcación de macrófagos en hígado de conejo control. 1h: Infiltración de macrófagos alrededor de la vena central (anticuerpo RAM11, barra: 20 μm). vc: vena central, ep: espacio porta.
El grupo alto trans presentó 8 conejos con fibrosis hepática, frecuencia que fue significativamente mayor (p 0,0246) a la registrada en el grupo control (3 conejos con fibrosis hepática). Además, los conejos del grupo alto trans evidenció estadios más avanzados de fibrosis hepática (Figura 1f) que el grupo control (Figura 1e).
Discusión
La leche con alta relación AGt/AGS indujo un leve pero significativo incremento del colesterol total plasmático en los conejos, al compararla con la leche con baja relación AGt/AGS. Nuestros resultados concuerdan con los resultados reportados en humanos y cobayos que recibieron lácteos con alta relación AGt/AGS. En humanos, 3,3% de la ingesta calórica diaria aportada por AGt de origen rumiante, cuyo principal isómero es trans-11 18:1, causó hipercolesterolemia e incrementó las subfracciones aterogénicas de las lipoproteínas5. En cobayos hipercolesterolémicos, una dieta con 15 g AGt de origen rumiante/100g de lípidos incrementó el colesterol total, C-LDL, C-HDL y triglicéridos. Estos resultados fueron similares al grupo de cobayos que recibió la misma dosis de AGt industriales. Esto demostró que los AGt de origen rumiante y de origen industrial, a pesar de su distribución isomérica diferente, cuando se consumió en altas dosis tuvieron el mismo efecto sobre factores de riesgos plasmáticos para enfermedad cardiovascular en cobayos17.
Los incrementos séricos de ALT y AST son, usualmente, buenos predictores de la degeneración grasa hepática no alcohólica19. El grupo de conejos que consumió leche con alta relación AGt/AGS durante 15 días, registró elevados niveles de ALT, con valores normales de AST. Dicho patrón bioquímico de transaminasas fue el típicamente observado en humanos asintomáticos con estadios iniciales de degeneración grasa hepática no alcohólica19. En ratas, luego de una intoxicación aguda (15 días) con 2000 mg/kg de peso vivo de una grasa láctea con alta relación AGt/AGS (27,30% de AGt y 51,20% de AGS), se reportó una leve degeneración vacuolar de hepatocitos y rarefacción citoplasmática hepatocelular1. En nuestra experiencia, el incremento de ALT sugirió que pudo ser causado por daño hepatocelular en los conejos que consumieron leche con alta relación AGt/AGS. Más tarde, durante la inducción de hipercolesterolemia, los incrementos graduales en los niveles séricos de ALT y AST concordaron con la evolución sérica de las transaminasas causada por la degeneración grasa hepática inducida por colesterol en este modelo10. Durante esta fase, el grupo que recibió leche con alta relación AGt/AGS continuó registrando un significativo incremento en la tasa sérica de ALT. Este resultado estuvo en concordancia con el mayor contenido de lípidos y con los hallazgos histopatológicos detectados en hígado de este grupo de animales. El hígado de los conejos que consumieron leche con alta relación AGt/AGS registro aumento del área sudanofílica, mayor frecuencia de fibrosis e incremento de infiltración de macrófagos, que el hígado de los conejos que consumieron una leche con baja relación AGt/AGS. En concordancia con nuestros hallazgos histopatológicos, la fibrosis del hígado comenzó en la zona centrolobulillar en respuesta a la necrosis de hepatocitos con degeneración grasa que ocurrió con mayor severidad en esta zona del lobulillo3, 14. Cuando la enfermedad avanzó, la fibrosis progresó a la zona portal y formaron puentes de fibrosis3; como se registró en un conejo del grupo alto trans. La fibrosis indica daño hepático irreversible y, si el daño hepatocelular continúa, puede progresar a cirrosis3. Por otra parte, el recuento de macrófagos se incrementó alrededor de la vena central del lobulillo en respuesta al mayor grado de degeneración grasa de hepatocitos15.
A diferencia de nuestros resultados, el efecto individual de trans-11 18:1, principal AGt de origen rumiante, demostró mejorar los síntomas del síndrome metabólico y reducir la esteatosis hepática en ratas7. Sin embargo, este trabajo evaluó el efecto específico de un ácido graso, que puede diferir con el efecto fisiológico de un alimento complejo como la leche20. Otro trabajo demostró que una manteca reducida en AGS (41,2%) y enriquecida con trans-11 18:1 (7%) y cis-9, trans-11 18:2 (2,6%) no indujo esteatosis hepática en conejos hipercolesterolémicos4. Dicha diferencia puede deberse a la diferente concentración de ácidos grasos de la leche y a la diferente dosis de colesterol empleada.
Nuestros resultados concuerdan con la degeneración grasa hepática reportada al modificar el perfil de AGt en la leche (sustitución de trans-11 18:1 por trans-10 18:1 como principal AGt). Una grasa láctea con altos niveles de AGt (11,8% de trans-10 C18:1 y 1,8% de trans-11 18:1) y reducida en AGS (41,9%) incrementó el colesterol ligado a lipoproteínas de muy baja densidad, incrementó los ácidos grasos no esterificados plasmáticos, incrementó la glucemia e indujo degeneración grasa hepática en un grupo de conejos4. Nuestros resultados también concordaron con los efectos de sustituir los AGS por AGt industriales en modelos experimentales de degeneración grasa hepática no alcohólica. La tasa sérica de ALT, la degeneración grasa, la respuesta inflamatoria (FNTα) y la respuesta pro-fibrogénica (pro-colágeno) en el hígado de ratones, fueron sustancialmente mayores cuando recibieron una dieta con 30% de AGt de aceite vegetal hidrogenado; comparado con una dieta isocalórica conteniendo AGS22. En otro modelo, ratones alimentados con una dieta rica en AGt de origen industrial (20% del aporte energético) registraron resistencia a la insulina, altos valores de ALT e incrementaron la IL-1β en hígado; cuando se comparó con ratones alimentados con grasa de cerdo (calóricamente idéntica, pero sin grasas trans)11. El exceso de AGt industriales en la dieta incrementó la expresión hepática de genes lipogénicos14, 24, la afluencia de ácidos grasos no esterificados al hígado, la acumulación hepática de peróxidos lipídicos e indujo degeneración grasa hepática14.
Podemos especular que el alto contenido de AGt (~25%) de la leche con alta relación AGt/AGS contribuyó a incrementar el colesterol total plasmático e indujo degeneración grasa hepática más extensa, con incremento de fibrosis y mayor infiltración de macrófagos en el hígado de los conejos. Por otra parte, el menor contenido de AGP cis (en particular cis-9,cis-12,cis-15 18:3) de la leche con alta relación AGt/AGS (Tabla 1), también pudo haber contribuido a estos efectos; debido que los AGP cis redujeron la esteatosis hepática en ratas21 y en ratones6.
En conclusión, el consumo de una leche con alta relación AGt/AGS contribuyó a incrementar la colesterolemia y a incrementar el efecto hepatotóxico del colesterol en conejos machos, cuando se comparó con una leche con baja relación de AGt/AGS. Dichos efectos estén, posiblemente, relacionados con el contenido de AGt de esta leche.
Bibliografía
1. Anadón, A.; Martínez-Larrañaga, M.R.; Martínez, M.A.; et al. Acute oral safety of dairy fat rich in trans-10 C18:1 versus vaccenic plus conjugated linoleic acid in rats. Food Chem. Tox. 2010; 48:591-598.
2. Bauchart, D.; Roy, A.; Lorenz, S.; et al. Butters varying in trans 18:1 and cis-9,trans-11 conjugated linoleic acid modify plasma lipoproteins in the hypercholesterolemic rabbit. Lipids 2007; 42:123-133.
3. Brunt, E.; Tiniakos D. Histopathology of nonalcoholic fatty liver disease. World J. Gastroenterol. 2010; 16:5286-5296.
4. Faulconnier, Y.; Roy, A.; Ferlay, A.; et al. Effect of dietary supply of butter rich in trans-10-18:1 or in trans-11-18:1 plus cis-9, trans-11-18:2 on rabbit adipose tissue and liver lipogenic activities. Brit. J. Nutr. 2006; 96:461-468.
5. Gebauer, S.K.; Destaillats, F.; Dionisi, F.; Krauss, R.M.; Baer, D.J. Vaccenic acid and trans fatty acid isomers from partially hydrogenated oil both adversely affect LDL cholesterol: double-blind, randomized controlled trial. Am. J. Clin. Nutr. 2015; 102:1339-1346.
6. González-Périz, A.; Horrillo, R.; Ferré, N.; et al. Obesity-induced insulin resistance and hepatic steatosis are alleviated by ω-3 fatty acids: a role for resolvins and protectins. FASEB J. 2009; 23:1946-1957.
7. Jacome-Sosa, M.M.; Borthwick, F.; Mangat, R.; et al. Diets enriched in trans-11 vaccenic acid alleviate ectopic lipid accumulation in rat model of NAFLD and metabolic syndrome. J. Nutr. Biochem. 2014; 25:692-701.
8. Kainuma M, Fujimoto M, Sekiya N, et al. Cholesterol-fed rabbits as a unique model on nonalcoholic, nonobese, non-insulin-resistant fatty liver disease with characteristic fibrosis. J.Gastroenterol. 2006; 41:971-980.
9. Kleiner, D.E.; Brunt, E.M.; Van Natta, M.; et al. Design and validation of histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41:1313-1321.
10. Kolodgie, F.D.; Katocs, A.S.; Largis, E.E.; et al. Hypercholesterolemia in the rabbit induced by feeding graded amounts of low-level cholesterol. Arterioscler. Thromb. Vasc. Biol. 1996; 16: 1454-1464
11. Koppe, S.W.P.; Elias, M.; Moseley, R.H.; Green, R.M. Trans fat feeding results in higher serum alanine aminotransferase and increased insulin resistance compared with a standard murine high-fat diet. Am. J. Physiol. Gastrointest. Liver Physiol. 2009; 297:378-384.
12. Malpuech-Brugére, C.; Mouriot, J.; Boue-Vaysse, C.; et al. Differential impact of milk fatty acid profiles on cardiovascular risk biomarkers in healthy men and women. Eur. J. Clin Nutr. 2010; 64:752-759.
13. Motard-Bélanger, A.; Charest, A.; Grenier, G.; et al. Study of the effect of trans fatty acids from ruminants on blood lipids and other risk factors for cardiovascular diseases. Am. J. Clin Nutr. 2008; 87:593-599.
14. Obara, N.; Fukushima, K.; Ueno, Y.; et al. Possible involvement and the mechanisms of excess trans-fatty acid consumption in severe NAFLD in mice. J. Hepatol. 2010; 53:326-334
15. Ogawa, T.; Fujii, H.; Yoshizato, K.; Kawada, N. A human-type nonalcoholic steatohepatitis model with advanced fibrosis in rabbits. Am.J.Pathol. 2010; 177:153-165.
16. Pintus, S.; Murru, E.; Carta, G.; et al. Sheep cheese naturally enriched in α-linolenic, conjugated linoleic and vaccenic acids improves the lipid profile and reduces anandamide in the plasma of hypercholesterolaemic subjects. Br. J. Nutr. 2013; 109:1453-1462.
17. Rice, B.H.; Kraft, J.; Destaillats, F.; Bauman, D.E.; Lock, A.L. Ruminant-produced trans-fatty acids raise plasma total and small HDL particles concentrations in male Hartley guinea pigs. J. Nutr. 2010; 140:2173-2179.
18. Roy, A.; Chardigny, J.M.; Bauchard, D.; et al. Butters rich either in trans-10-C18:1 or in trans-11C18:1 plus cis-9, trans-11 CLA differentially affect plasma lipids and aortic fatty streak in experimental atherosclerosis in rabbits. Animal 2007; 1:467-476.
19. Sattar, N.; Forrest, E.; Preiss, D. Non-alcoholic fatty liver diseases. BMJ 2014; 349:g4596.
20. Shingfield, K.J.; Chilliard. Y.; Toivonen, V.; Kairenius, P.; Givens, D.I. Trans fatty acids and bioactive lipids in ruminant milk. Adv. Exp. Med. Biol. 2008; 606:3-65.
21. Svegliati-Baroni, G.; Candelaresi, C.; Saccomanno, S.; et al. A model of insulin resistance and nonalcoholic steatohepatitis in rats, role of peroxisome proliferator-activated receptor-α and n-3 polyunsaturated fatty acid treatment on liver injury. Am.J.Pathol. 2006; 169:846-860.
22. Tetri, L.H.; Basaranoglu, M.; Brunt, E.M.; Yerian, L.M.; Neuschwander-Tetri, B.A. Severe NAFLD with hepatic necroinflammatory changes in mice fed trans fats and a high-fructose corn syrup equivalent. Am. J. Physiol. Gastrointest. Liver Physiol. 2008; 295:987-995.
23. Tholstrup, T.; Raff, M.; Basu, S.; Nomboe, P.; Sejrsen, K.; Straarup, E.M. Effects of butter high in ruminant trans and monounsaturated fatty acids on lipoproteins, incorporation of fatty acids into lipid classes, plasma C-reactive protein, oxidative stress, hemostatic variables, and insulin in healthy young men. Am. J. Clin. Nutr. 2006; 83:237-243.
24. Vahmani, P.; Meadus, W.J.; Duff, P.; Rolland, D.C.; Dugan, M.E.R. Comparing the lipogenic and cholesterolgenic effects of individual trans-18:1 isomers in liver cells. Eur. J. Lipid Sci. Technol. 2016; https://doi.org/10.1002/ejlt.201600162.
25. Yin, W.; Carballo-Jane, E.; MCLaren, D.G.; et al. Plasma lipid profiling across species for the identification of optimal animal model of human dyslipidemia. J. Lipid Res. 2012; 53: 51-65.



