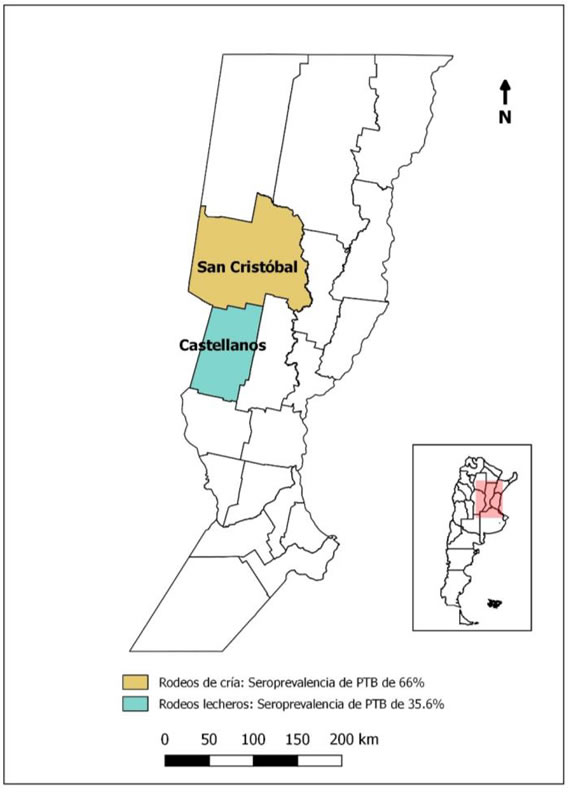
Figura 1. Provincia de Santa Fe – departamentos donde se realizó el relevamiento.
ARTÍCULO DE INVESTIGACIÓN
Seroprevalencia de paratuberculosis bovina en rodeos de cría y de leche de dos departamentos de la provincia de Santa Fe (Argentina)
Abdala, A.1; Aguirre N.1; Luca, E. 2,3; Storani, G. 3; Storero, R.3; Torioni de Echaide, S.1
1EEA INTA Rafaela.
2Facultad de Ciencias Veterinarias, Universidad Nacional del Litoral.
3Actividad privada.
Recibido: 10/08/2018
Aceptado: 17/04/2019
Correspondencia e-mail: Alejandro Abdala abdala.alejandro@inta.gob.ar
Resumen
La paratuberculosis (PTB) es una enfermedad crónica granulomatosa del tracto gastrointestinal causada por Mycobacterium avium subsp. paratuberculosis (MAP), que afecta a rumiantes domésticos y silvestres. La enfermedad ha sido identificada en rodeos bovinos productores de leche y carne de Argentina, pero con escasas estimaciones de prevalencia. Para caracterizar la situación de la PTB en rodeos bovinos de la provincia de Santa Fe, se determinó la prevalencia serológica en bovinos productores de leche y carne mediante un ELISA comercial. El estudio se llevó a cabo en los departamentos Castellanos y San Cristóbal que incluyen una proporción significativa del ganado provincial que produce leche y carne, respectivamente. Se estudiaron 70 establecimientos por sistema productivo, con un mínimo de 20 vacas por rodeo. La prevalencia de PTB en rodeos y bovinos fue de 35,6% y del 2,1% para ganado lechero y del 66% y 9% para ganado de carne, respectivamente. Contrariamente a lo esperado, los sistemas extensivos para la producción de carne tuvieron prevalencias más elevadas que los sistemas lecheros. Estos resultados sugieren la necesidad de implementar un programa oficial para el control de PTB que incluya inicialmente cabañas de reproductores para evitar su propagación con los movimientos de ganado.
Palabras clave: Paratuberculosis; Seroprevalencia; Rodeos de cría; Rodeos de leche.
Prevalence of paratuberculosis in dairy and beef catlle in two department of Santa Fe province (Argentina)
Summary
Paratuberculosis (PTB) is a granulomatous chronic disease of the gastrointestinal tract of domestic and wild ruminants, caused by Mycobacterium avium subsp. paratuberculosis (MAP). The disease has been identified previously in dairy and beef cattle herds of Argentina, however the prevalence estimates are scarce. To characterize the PTB situation in both cattle production system of Santa Fe province, the serological prevalence in dairy and beef cattle herds was determined through a commercial ELISA. The study was carried on Castellanos and San Cristobal departments that include a significant proportion of the provincial cattle that produce milk and meat, respectively. Seventy herds were studied for each productive system, with a minimum of 20 cows sampled per herd. PTB prevalence at the herd and bovines level was 35.6% and 2.1% for dairy cattle and 66% and 9% for beef cattle respectively. Unexpectedly, the meat production systems showed higher prevalence than dairy systems. These results strongly suggest that Argentina should implement an official PTB control program that include particularly breeder cabins, to preclude its spread with livestock movement.
Key words: Paratuberculosis; Prevalence; Dairy herd; Beef cattle.
Introducción
La paratuberculosis (PTB) es una enfermedad crónica granulomatosa del tracto gastrointestinal de los rumiantes y otras especies, causada por Mycobacterium avium subsp. paratuberculosis (MAP). Los signos clínicos se manifiestan en bovinos adultos, ocasionando cuadros de diarrea crónica severa, disminución de la producción láctea, pérdida de la condición corporal que culmina con la muerte.
Los bovinos jóvenes son altamente susceptibles a la infección por MAP, la que se produce vía fecal-oral a partir de la materia fecal de los bovinos adultos infectados que contaminan el calostro, la leche, el agua y los alimentos. La transmisión vía uterina también puede ser otra vía de infección34.
En la etapa temprana de la infección las lesiones se encuentran restringidas a las paredes del intestino delgado y linfonodos que drenan la zona, cuando la enfermedad progresa las lesiones se observan en la porción final del íleon, ciego, colon y nódulos linfáticos mesentéricos25. La pared intestinal se observa engrosada, edematosa y con pliegues transversales. La serosa y los linfonodos aparecen pálidos, hinchados y edematosos. Histopatológicamente la lesión es una inflamación granulomatosa, difusa, multifocal del intestino y de los nodos linfáticos26. Estas lesiones del sistema digestivo son las responsables de la pérdida de proteínas y del síndrome de mala absorción proteica, conduciendo a un desgaste muscular, estos signos clínicos se pueden presentar en bovinos mayores de 1-2 años25.
Luego de algunas semanas de iniciada la infección por MAP, comienza su multiplicación en las paredes del intestino delgado. Dependiendo de la resistencia del individuo, éste puede eliminar la infección o permanecer infectado como portador asintomático, aunque se desconoce la proporción en que este evento ocurre. La última fase de la multiplicación del MAP se caracteriza por la extensión de las lesiones, la interferencia con el metabolismo intestinal y la presencia de los signos clínicos de la enfermedad. Los portadores subclínicos excretan un número variable de MAP en las heces, pero cuando se desarrolla la enfermedad clínica se excretan un gran número de bacilos25.
La infección por MAP genera una respuesta inmune de hipersensibilidad de tipo retardado (HTR) similar a las inducidas por las micobacterias productoras de tuberculosis y de lepra26 (Bendixen P H, citado por Olsen et al., 2002). La HTR se detecta tempranamente durante la infección y puede permanecer en bovinos con infección asintomática, sin embargo, al progresar la enfermedad la HTR decrece y puede estar ausente en los casos de enfermedad clínica. Los anticuerpos se detectan con posteridad a la HTR, y en general se mantienen constantes y su título aumenta cuando las lesiones se hacen más extensas25.
En Argentina la enfermedad ha sido reconocida en bovinos de carne de siete partidos de la Cuenca del Salado (provincia de Buenos Aires), con prevalencias que variaron entre 7,1% y 19.6% en bovinos y del 14,4% al 43,7% en rodeos23. Una evaluación posterior en esta misma provincia demostró valores de 26,5% en bovinos para carne y del 56% en bovinos para leche27. En el mismo trabajo se reportaron prevalencias para ganado de cría del 2,4% para La Pampa, 1% para Catamarca, 2% para La Rioja y 7% para Río Negro. En otras provincias como Córdoba, la prevalencia serológica en vacas y rodeos lecheros fueron del 0,3 % y 5,3 % respectivamente17. La enfermedad también fue reconocida en rodeos lecheros de las provincias de Corrientes19 y de Salta21.
En Santa Fe donde la existencia de ganado bovino de cría excede los 4 millones de cabezas y la de leche está en el orden del 1.2 millones22, la ocurrencia de PTB ha sido reportada sólo por algunos pocos veterinarios de la actividad privada. El objetivo del trabajo fue estimar la seroprevalencia de PTB en rodeos para carne del departamento San Cristóbal y para leche del departamento Castellanos, donde respectivamente estas producciones ganaderas se destacan.
Materiales y métodos
Se diseñó un muestreo en base a los 1.489 rodeos de cría registrados en el departamento San Cristóbal y en los 1.274 tambos del departamento Castellanos22 (Ministerio de la Producción Santa Fe, 2007). Se estimó una prevalencia de PTB esperada del 5% para rodeos y del 1% para bovinos, con un 95% de confianza y un 5% de error (WinEpiscope) para ambos sistemas productivos. El diseño determinó el estudio de al menos 70 establecimientos para cada uno de los sistemas, con un mínimo de 20 muestras por rodeo. Las muestras de suero se obtuvieron a través de tres laboratorios privados de la Red del SENASA de brucelosis, receptores de muestras de sangre enviadas por los veterinarios de la actividad privada de los rodeos que realizan el control de esta enfermedad. Las muestras de suero se seleccionaron al azar, correspondiendo siempre a la categoría vacas. Se utilizó un kit de ELISA comercial (ID VetScreen Paratuberculosis Indirect 1653-RD) para la detección de anticuerpos contra MAP en suero bovino. Se consideró positiva a la muestra que superara el 70% (punto de corte) de la relación S/P (muestra/ control positivo) indicado por el kit de diagnóstico, según la fórmula siguiente:
DOmuestra–DOcontrol negativo
--------------------------------------- X 100
DOcontrol positivo –DOcontrol negativo
Resultados
Se obtuvieron 2.900 muestras de suero bovino, correspondientes a 75 rodeos de cría y 70 lecheros. Los rodeos de cría se encontraban distribuidos en dieciocho distritos del departamento San Cristóbal y los lecheros en veinticuatro distritos de Castellanos (Figura 1). La prevalencia de rodeos positivos a PTB fue del 66% para los de carne y del 35,6% para los lecheros, mientras que la seroprevalencia en bovinos fue del 9% para los de carne y del 2,1% para los lecheros.

Figura 1. Provincia de Santa Fe – departamentos donde se realizó el relevamiento.
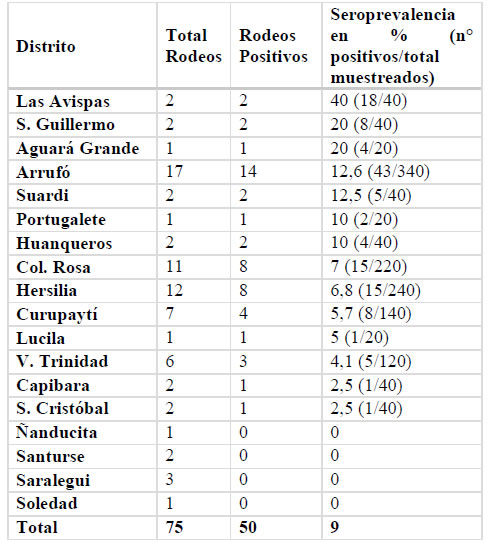
Sobre un total de 18 distritos de San Cristóbal, 14 resultaron con serología positiva en algunos de sus rodeos, las prevalencias más elevadas se observaron en los distritos de San Guillermo y Las Avispas. En este último distrito se identificó un rodeo con 16 positivas a PTB de las 20 muestras analizadas (Tabla 1).
Tabla 1. Detalle por distrito de las determinaciones serológicas (ELISA) de PTB en rodeos de carne del departamento San Cristóbal, Santa Fe. Los distritos se ordenaron de acuerdo con los valores de seroprevalencia obtenidos.
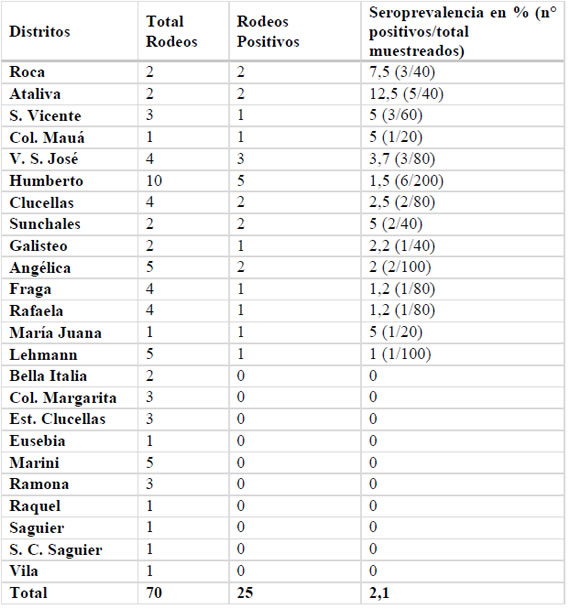
En el departamento Castellanos 14 distritos sobre los 24 relevados presentaron al menos un animal con serología positiva, las seroprevalencias más elevadas se observaron en vacas lecheras de los distritos de Roca, Ataliva, Colonia Mauá, y Villa San José (Tabla 2). El único rodeo positivo del distrito de San Vicente presentó el mayor número de bovinos reaccionantes, 3 sobre el total de 20. La mayor seroprevalencia de PTB en rodeos lecheros fue del 15% y se detectó en dos rodeos uno de Ataliva y el otro de San Vicente, con tres positivos sobre las 20 muestras analizadas.
Tabla 2. Detalle por distrito de las determinaciones serológicas (ELISA) de PTB en rodeos lecheros del departamento Castellanos, Santa Fe. Los distritos se ordenaron de acuerdo con los valores de seroprevalencia obtenidos.
Discusión
La elevada proporción de rodeos con PTB observada tanto para ganado de cría (66,7%) en el 78% de los distritos del departamento San Cristóbal, como para el ganado lechero (35,6%) en el 58% de los distritos del departamento Castellanos, indicaría que la enfermedad es endémica en la región y que su dispersión es mayor en el ganado de cría que en el lechero. La proporción de rodeos lecheros positivos a PTB es menor a la reportada en otros países latinoamericanos como en el estado de Espíritu Santo (Brasil) con un 87%6 y en el sur de Chile con valores que fluctúan del 28% al 100%, de acuerdo al tamaño de los rodeos y la técnica de diagnóstico utilizada14.
La seroprevalencia individual promedio de PTB en ganado de cría (9%) fue cuatro veces superior a la encontrada en el ganado lechero (2.1%), resultado que contrasta con la información obtenida para la Cuenca del Río Salado (Buenos Aires), donde la seroprevalencia promedio para ganado lechero fue del 18,8% con un riesgo de infección mayor (OR=3,9) que para bovinos de carne3. En otro trabajo, para la misma provincia, la prevalencia de PTB también fue mayor para bovinos lecheros (56%) respecto de los carniceros (26,5 %)30. Llama la atención la mayor seroprevalencia encontrada en bovinos para carne respecto de los lecheros de la provincia de Santa Fe, ya que los antecedentes en otra región del país27 y en el extranjero indican lo contrario32.
En el 93% de los distritos positivos del departamento San Cristóbal la seroprevalencia intrapredial en bovinos para carne varió entre el 3 y 20%, coincidiendo estos valores con los encontrados en la Cuenca del Salado de 7,1 al 19,6%23 para el mismo tipo de sistema productivo. Exceptuando un rodeo del distrito Las Avispas con un 45% de reactores seropositivos, resultado que no pudo ser explicado, la seroprevalencia intrapredial fue similar al promedio reconocido del 17% en bovinos para Latinoamérica y el Caribe8. Hay diferentes factores de riesgo propuestos como precipitantes de la faz clínica de infección como la crianza intensiva, la acidez del suelo, la deficiente nutrición, el estrés por transporte, la lactación, el parto, y el virus de la diarrea viral bovina12. La crianza intensiva no justifica las diferencias de PTB encontradas entre los dos sistemas productivos de la provincia de Santa Fe. Los sistemas productivos intensivos favorecen la diseminación de MAP a través del contacto entre vacas adultas infectadas, con el riesgo adicional del consumo de calostro o leche contaminada utilizada para la alimentación de los terneros28. Este sistema productivo es inherente al ganado lechero de la región, por lo que cabría esperar una mayor prevalencia de PTB en este tipo de ganado, ya que en contraste los sistemas productivos de bovinos para carne del departamento San Cristóbal son netamente extensivos4. Habría que considerar como un factor de control de la PTB para el ganado lechero, el alto grado de reemplazo de vacas, por diferentes problemas sanitarios, debido a que limita la permanencia de las vacas en los rodeos. Un trabajo en Argentina reveló que el 77% de las vacas lecheras no supera su tercera lactancia2, lo que llevaría a una disminución de la observación de casos clínicos y a una disminución de la contaminación del ambiente.
Las características de los suelos donde se desempeñan ambos tipos de explotaciones son diferentes, los rodeos de carne se ubican sobre suelos mal y pobremente drenados y salinos/sódicos (Natracualfes), mientras que los lecheros se ubican sobre suelos bien y moderadamente drenados con horizontes superficiales de textura franco-limosa con bajo contenido de arena (Argiudoles)11. Estas características de los suelos hacen que tengan pH diferentes, siendo los Natracualfes levemente más alcalinos que los Argiudoles, cuyo pH tiende a descender por el uso intensivo de laboreos y cultivos (Área de Recursos Naturales y Suelo INTA Rafaela, comunicación personal 2017). Existen trabajos donde se relaciona el pH ácido de los suelos de una región como favorecedor de la persistencia de MAP13, 29, 20. Otro trabajo relaciona el pH y el contenido de hierro (Fe) de los suelos, aumentando la prevalencia de MAP en ovinos cuando mayor cantidad de Fe poseen, pero la asociación entre el pH del suelo y la infección por MAP fue no concluyente7. Dietas ricas en Fe aumentan la eliminación de MAP en los animales infectados y producen un descenso de los niveles de cobre (Cu) en sangre15. Respecto al Cu en ambos ambientes productivos se presentan bajos niveles en sangre, pero mayormente en el sistema de cría debido al exceso de molibdeno (Mo) y de azufre (S) en forrajes y agua30, 18. El Cu es transportado en sangre por una proteína, la ceruloplasmina, la cual decrece durante su deficiencia37. La ceruloplasmina es una proteína de fase aguda, que participa en el montaje de la respuesta inmune, de manera que una deficiencia de Cu alteraría la respuesta proinflamatoria de macrófagos y neutrófilos. Bajos niveles de ceruloplasmina impedirían el mecanismo de feedback necesario para detener toda respuesta inflamatoria, resultando en una condición de inflamación crónica que repercutiría sobre el crecimiento y la producción1. La prevalencia elevada de MAP coincidiría con los bajos niveles de Cu que se aprecian en los rodeos de cría. Sin embargo, esta deficiencia de Cu por interferencia de Mo, no alteraría dramáticamente la inmunidad en los bovinos estresados35. La interacción entre factores nutricionales/químicos requieren de mayores estudios para aclarar el rol que juegan en la fagositosis, en la inmunidad mediada por células y los requerimientos especiales del MAP como patógeno, cuya virulencia parece ser dependiente del contexto16. Otro aspecto a considerar entre rodeos de carne y leche es la composición racial que predomina en cada uno, en los de carne intervienen animales mayoritariamente cruza Bos taurus x Bos indicus y en el lechero exclusivamente Bos taurus, existiendo 3.6 veces más de riesgo que resulten con serología positiva los cruzas indicas x europeo que los europeos puros31. Pero el mismo autor considera que existirían otras variables además de la raza, que justifiquen estas observaciones31.
Respecto a los movimientos de bovinos, el departamento San Cristóbal es uno de los principales emisores y receptores de bovinos de Argentina, en todas sus categorías, particularidad que no tiene igual magnitud en el departamento Castellanos33. Durante los años 2015/16 el ingreso de bovinos provenientes de establecimientos de la provincia de Buenos Aires a establecimientos santafesinos fue de 396.000 animales, siendo Santa Fe el tercer destino de importancia, mientras que el movimiento inverso fue un tercio de esa cifra33. Esta particularidad de movimientos de bovinos no habría involucrado al ganado lechero ya que los partidos emisores de bovinos bonaerenses correspondieron a la Cuenca del Salado, principal zona criadora de terneros del país24. La seroprevalencia de PTB en esa región es una de las mayores registradas en la provincia de Buenos Aires23. La introducción de reproductores bovinos de esa región a los rodeos de cría del departamento San Cristóbal podría explicar en parte las altas prevalencias de PTB en esos rodeos. En Argentina, Gioffré y colaboradores10 utilizando técnicas moleculares reconocieron diferentes patrones de MAP dentro de un mismo rodeo, e incluso les permitió detectar el ingreso de un patrón diferente a los existentes en uno de los rodeos a través de la introducción de un reproductor. Sería importante contar con aislamientos de cepas de MAP de ambos departamentos, para a través de estas técnicas, evaluar su origen y relación con las de la Cuenca del Salado o de otras regiones del país. La herramienta diagnóstica utilizada en este trabajo es similar a la utilizada en relevamientos en otros países, a pesar de sus limitaciones. La sensibilidad de la prueba reportada varía entre el 27,8 y el 44,5%5 o entre el 30,2 y el 41,5%9 con una especificidad del 94,9% al 99,8%5 y > 99%9, respectivamente. La habilidad de la prueba de ELISA para detectar bovinos infectados está en relación directa con el nivel de eliminación del MAP por materia fecal y su sensibilidad varía según la etapa de infección36. La técnica fue capaz de identificar bovinos infectados en más del 72% de los casos, cuando eliminaban gran cantidad de MAP por gramo de materia fecal5. Considerando este punto, la seroprevalencia obtenida estaría subestimando la infección real existente en los rodeos evaluados. Por otro lado, el kit comercial de ELISA utilizado en este estudio no ha sido validado en Argentina, por lo que sería indispensable la confirmación de los resultados por pruebas complementarias como el cultivo bacteriológico y la técnica de PCR para detectar MAP en muestras de materia fecal. A pesar de sus limitaciones la prueba de ELISA es una herramienta útil de aplicación masiva que permite dar información sobre la dispersión de la PTB y hasta el momento es la prueba más sensible y específica para la detección de anticuerpos séricos contra MAP en el ganado bovino9.
La ausencia de casos clínicos reportados en los rodeos de Santa Fe, contrasta con la situación de los rodeos de la provincia de Buenos Aires, caracterizados por la presencia de casos clínicos asociados con prevalencias de PTB elevadas23,27. Posiblemente el manejo más extensivo de los rodeos de cría en Santa Fe y el desconocimiento de la enfermedad por parte de los productores, dificulte el diagnóstico de los casos clínicos y la identificación de MAP como causa de muerte.
Este trabajo permitió conocer la presencia de anticuerpos de PTB en dos departamentos de la provincia de Santa Fe para diferentes tipos de explotaciones ganaderas. Futuros estudios epidemiológicos que incluyan análisis de factores de riesgo, son necesarios para explicar las diferencias encontradas entre los diferentes sistemas productivos. Argentina debería contar con un programa nacional de control de PTB que incluya en una primera etapa a las cabañas de reproductores, a fin de evitar su difusión a nuevos rodeos con el movimiento de estos animales.
1. Arthington, J. Trace mineral nutrition and immune competence in cattle. Proceeding of 17 th Annual Ruminant Nutrition Symposium Gainsesville, Florida, February 1-2, 2006.
2. Bargo, F., Busso, F., Corbellini, C., Grigera, J.M., Lucas, V., Podetti, V., Tuñon, G., Vidaurreta, I. 2009. Organización y Análisis de un Sistema de Registros de Enfermedades del Periparto en Vacas Lecheras: su Incidencia e Impacto Económico sobre las Empresas. Convenio de Asistencia Técnica Institucional INTA -Elanco-AACREA. http://www.pmpllaserenisima.com.ar:8090/Images/comunicados/noticias/Reporte%20final%20Claves.pdf Consultado 30 de mayo 2018.
3. Becker, B.; Perez, A.; Späth, E.; Paolicchi, F.; Morsella, C. Distribución y factores de riesgo de paratuberculosis bovina en la Pampa Húmeda Argentina. XII Simposio Internacional de la Asociación Mundial de Laboratorios de Diagnóstico Veterinario (WAVLD), 2005, Resumen 117, Montevideo, Uruguay
4. Castignani, Horacio. Zonas Agroeconómicas Homogéneas Santa Fe. Estudios socioeconómicos de la sustentabilidad de los sistemas de producción y recursos naturales INTA EEA Rafaela. Marzo 2011. https://inta.gob.ar/documentos/zonas-agroeconomicas-homogeneas-santa-fe. Consultado 29 de marzo 2018.
5. Collins, M. T.; Wells, S. J.; Petrini, K. R.; Collins, J. E.; Schultz, R. D. and Witlock, R. H. Evaluation of five antibody detection test for diagnosis of bovine paratuberculosis. Clinical and Diagnostic Laboratory Immunology. 2005; 12 (6): 685-92.
6. Costa, J.C.M.; Pieri, F.A.; Souza, C.F.;Espeschit, I.F.; Felippe, A.G.; Santos G.M., Tobia, F.L.; Silva-Junior, A. & Moreira, M.A.S. Levantamento sorológico de Mycobacterium avium subsp. paratuberculosis em bovinos leiteiros no estado do Espírito Santo. Arq. Bras. Med. Vet. Zootec. 2010; 62(6):1491-4.
7. Dhand, N. K.; Eppleston, J.; Whittington, R. J., & Toribio, J. Association of farm soil characteristics with ovine Johne's disease in Australia. Prev Vet Med. 2009; 89 (1-2): 110-20.
8. Fernández-Silva, J. S.; Correa-Valencia, N.M.; Ramírez, N. F. Systematic review of the prevalence of paratuberculosis in cattle, sheep, and goats in Latin America and the Caribbean. Trop Anim Healt Prod. 2014; 46: 1321-40.
9. Fry, M. P.; Kruze,J.; Collins, M, T. Evaluation of four commercial enzyme-linked immunosorbent assay for the diagnosis of bovine paratuberculosis in Chilean herds. J Vet Diagn Invest; 2008; 20: 329-32.
10. Gioffré, A.; Correa Muñoz, M.; Alvarado Pinedo, M.F.; Vaca, R.; Morsella, C.; Fiorentino, M.A.; Paolicchi, F.; Ruybal, P.; Zumárraga, M.; Travería, G. E.; Romano, M. I. Molecular typing of Argentinian Mycobacterium avium subsp. paratuberculosis isolates by multiple-locus variable number-tandem repeat analysis. Brazilian Journal of Microbiology 2015; 46 (2): 557-64.
11. Giorgi, R.; Tosolini, R.; Sapino, V.; Villar, J.; León, C.; Chiavassa, A. Zonificación Agroeconómica de la Provincia de Santa Fe. Publicación Miscelánea N° 110. Instituto Nacional de Tecnología Agropecuaria 2008, 35 pp.
12. Kenndy, D. J.; Benedictus, G. Control of Mycobacterium avium subsp. Paratuberculosis infection in agricultural species. Rev. sci. tech. Off. Int. Epiz. 2001; (1): 151-79.
13. Kopecky, K. E. 1977. Distribution of paratuberculosis in Wisconsin, by soil regions. J Am Vet Med Assoc. 1977 Feb 1; 170 (3): 320-4.
14. Kruze, J., Monti, G., Schulz, F., Mella, A., Leiva, S., 2013. Herd-level prevalence of MAP infection in dairy herds of southern Chile determined by culture of environmental fecal samples and bulk-tank milk qPCR. Prev. Vet. Med. 111, 319-32.
15. Lepper, A.W.; Embury, D. A.; Lewis, V. M. Effects of altered dietary iron intake Mycobacterium paratuberculosis –infected dairy cattle: sequential observations on growth, iron and copper metabolism and development of paratuberculosis. Res Vet Sci. 1989; 36 (3): 289-96.
16. Lugton, I. W. Review of posible link between the clinical expression of paratuberculosis and deficiency of macro and micronutrients. Australian Veterinary Journal 2004, 82: 490-496.
17. Magnano, G.; Schneider, M.; Carranza, A.; Bérgamo, E.; Henriquez, M. B.; Giraudo, J. A. Evaluación serológica de paratuberculosis en el sudoeste de la provincia de Córdoba, Argentina. Vet. Arg. 2002; 11: 741-6.
18. Marcos, E. R.1985. Información sobre Producción Animal. Valores sanguíneos en ganado lechero del Centro-Oeste Santafesino. Estación Experimental Agropecuaria de Rafaela INTA. Información para Extensión, Agosto de 1981, 3pp.
19. Martinis Mercado, D.S.; Cicuta, M.E.; Boehringer, S.I.; Morsella, C.; Paolocchi, F. 2014. La Paratuberculosis y los bovinos lecheros de la provincia de Corrientes. En: http://www.unne.edu.ar/unnevieja/Web/cyt/cyt/2002/04-Veterinarias/V-059.pdf. Consultado 26 septiembre 2017.
20. Michel, A. L., Bastianello, S. S. 2000. Paratuberculosis in sheep: an emerging disease in South Africa. Veterinary Microbiology. 2000; 77: 299-307.
21. Micheloud, J. F.; Delgado, F.; Fiorentino, M. A.; Morsella, C.; Cirone, K. M.; Mendez, L.; Paolicchi, F. Diagnóstico de paratuberculosis bovina en la cuenca lechera del Valle de Lerma, Salta. XX Reunión científico Técnica Asociación Argentina de Veterinarios de Diagnóstico, 27-29 de noviembre, 2014. Tucumán, Argentina.
22. Ministerio de la Producción Santa Fe (2007). Sistema Sanitario Productivo y Participativo. Parte I Caracterización del rodeo bovino y distintos sistemas productivos en Santa Fe. Ministerio de la Producción, Santa Fe. 80pp.
23. Moreira, A.; Späth, E.; Morsella, C. Seroprevalencia de paratuberculosis bovina en siete partidos de la Cuenca del Salado. Rev. Arg. Prod. Anim. 1993; Vol 13 Sup.1.
24. Némoz, J. P. Principales características de la actividad ganadera vacunaen el área de la EEA Cuenca del Salado.inta.gob.ar/sites/default/files/script-tmp-inta_-_ganadera_vacuna_eea_cuenca_del_salado.pdf). consultado 26 de octubre 2017.
25. OIE, World Organization for Animal Health. Manual Terrestre de la OIE 2014. Paratuberculosis (enfermedad de Johne), Capítulo 2.1.15: 1 – 17.
26. Olsen, I.; Sigurðardóttir, Ó. G. and Djønne, B. Paratuberculosis with special reference to cattle. A Review Veterinary Quaterly 2002; 24 (1): 12-28.
27. Paolicchi, F.; Morsella, C.; Cirone, K.; Soler, J.; Spath, E., Zumárraga, M., Giofree, A.; Moreira, A., Verna, A.; Romano, M.; Cataldi, A. “Paratuberculosis en Argentina: Investigación, Diagnóstico, Epidemiología y Programa Voluntario para su control”. 12 International Symposium of the World Association of Veterinary Laboratory Diagnosticians, 16 al 19 de noviembre de 2005, Montevideo, Uruguay.
28. Spickler, Ana Rovid. Ficha técnica de Paratuberculosis. Última actualización: octubre 2017 http://www.cfsph.iastate.edu/Factsheets/pdfs/paratuberculosis.pdf consultado 16 de mayo de 2018.
29. Reviriego, F. J.; Moreno, M. A.; Domínguez, L. Soil type as a putative risk factor of ovine and caprine paratuberculosis seropositivity in Spain. Prev Vet Med. 2000; 44(3-4):167-73.
30. Rucksan, B. E.; Casaro, A.E.P.; Jaeschke, J.; Lagos, F. y Gonzáles Pondal, D. Trastornos clínicos-patológicos ocasionados en bovinos por el pastoreo de Melilotus alba. Rev. Arg. Prod. Anim. 1982; 2(6): 519-36.
31. Roussel, A. J.; Libal, M. C.; Whitlock, R. L.; Hairgrove, T. B., Barling, K. S.; Thompson, J. A. Prevalence of and risk factors for paratuberculosis in purebred beef cattle. JAVMA 2005; 226 (5): 773-78.
32. Roussel, A. J. Control of Paratuberculosis in Beef Cattle. Vet Clin Food Anim. 2011; 27, 593-98
33. SENASA http://www.senasa.gob.ar/sites/default/files/ARBOL_SENASA/INFORMACION/INFORMES%20Y%20ESTADISTICAS/Informes%20y%20estadisticas%20Animal/BOVINOS/BOVINOS/INFORMES%20ESTADISTICOS/movimientos_de_ganado_bovino_2016. Consultado 7 de febrero del 2018. https://www.argentina.gob.ar/sites/default/files/12.6_2007-2006.pdf
34. Sweney R. W. Transmission of paratuberculosis. Vet Clin North Food Anim Pract. 1996; 12 (2): 305-12.
35. Ward, J. D; Spears, J. W. The effects of low-copper diets with or without supplemental molybdenum on specific immune responses of stressed cattle. J Anim Sci. 1999; (1) :230-7.
36. Wells, S. J.; Collins, M. T.; Faaberg K. S.; Wees, C.; Tavornpanich, S.; Petrini, K. R.; Collins, J. E; Cernicchiaro, N. and Whitlock, R. H. Evaluation of a rapid fecal PCR test for detection of Mycobacterium avium subsp. paratuberculosis in dairy cattle. Clinical and Vaccine Immunology 2006; 13(10): 1125-30.