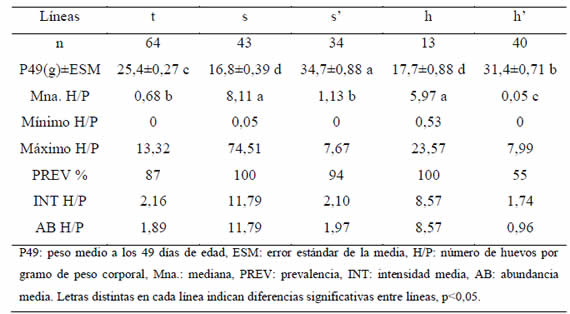
Tabla I. Peso y número de huevos por gramo por línea. Hembras.
ARTÍCULO DE INVESTIGACIÓN
Resistencia y tolerancia a oxiuros en cuatro líneas de ratones seleccionados por peso
Orozco, N.1; González Beltrán, S.2,4; Giudici, C.2,4 & Oyarzabal, M.I.3,4
1Becario CIN. Facultad de Ciencias Veterinarias, UNR.
2Cátedra de Enfermedades Parasitarias. Facultad de Ciencias Veterinarias, UNR.
3Cátedra Producción de bovinos para carne. Facultad de Ciencias Veterinarias, UNR.
4CIC, UNR.
Recibido: 23/08/2018
Aceptado: 27/12/2018
Correspondencia e-mail: María Inés Oyarzabal moyarzab@unr.edu.ar
Resumen
La habilidad del hospedador para reducir la carga parasitaria (resistencia) y limitar el daño causado por el patógeno (tolerancia) es el resultado de la co-evolución del complejo hospedador-huésped. Ésta está influenciada por múltiples factores, entre ellos, el genotipo del hospedador. En una población no seleccionada de ratones y dos pares de líneas de selección divergente para peso con más de 68 generaciones, infestadas naturalmente con Syphacia obvelata y Aspiculuris tetraptera, se evaluó si los genotipos de las líneas influían en la resistencia y tolerancia a estos parásitos. Se estimaron los siguientes parámetros: a) de resistencia: prevalencia, y abundancia e intensidad del número de huevos por gramo de peso corporal; b) de tolerancia: pendiente de la regresión del peso en el número de huevos. La prevalencia de una de las líneas seleccionada para alto peso fue significativamente menor (p<0,05); las líneas se ordenaron de menor a mayor abundancia e intensidad del número de huevos por gramo según el peso corporal y difirieron entre ellas (p<0,05). Las estimaciones de las tolerancias fueron no significativas para todas las líneas. La co-evolución de las líneasoxiuros condujo a una diferenciación de la resistencia adquirida pero no de la tolerancia, en la que está involucrado el genotipo de las líneas.
Palabras clave: Prevalencia; Tolerancia; Syphacia obvelata; Aspiculuris tetraptera; Mus musculus.
Resistance and tolerance to oxyuros in four mice lines selected for weight
Summary
The ability of the host to reduce the parasite load (resistance) and to limit the damage caused by the pathogen (tolerance) is the result of the co-evolution of the host-guest complex. This is influenced by multiple factors, including the host genotype. In a non selected mice population and in two pairs of lines of divergent selection for body weight for more than 68 generations, infested naturally with Syphacia obvelata and Aspiculuris tetraptera, it was evaluated whether the genotypes of the lines influenced the resistance and tolerance to these parasites. Prevalence and abundance and intensity of the number of eggs per gram of weight were estimated as resistance parameters. The slope of the regression of the weight in the number of eggs was estimated as tolerance parameter. One line selected for high weight showed a significantly lower prevalence than the others (p <0.05); the lines were ordered from the lowest to the highest abundance and intensity of the number of eggs per gram according to body weight. Tolerance estimations were not significant for all lines. The co-evolution of the lines-oxyuros led to a differentiation of the acquired resistance but not of the tolerance, in which the genotype of the lines is involved.
Key words: Prevalence; Ttolerance; Syphacia obvelata; Aspiculuris tetraptera; Mus musculus.
Introducción
La respuesta a la interacción entre hospedadores y parásitos depende, entre otros factores, de la capacidad del hospedador para reducir la carga parasitaria y/o disminuir el daño producido por la patogenia del parásito. La importancia de la separación e identificación de ambas estrategias radica en su relación con la salud del hospedador, éste puede vivir saludablemente con una alta carga parasitaria o morir con una carga baja, dependiendo de factores inmunológicos, genéticos y ambientales20,13.
La resistencia está relacionada inversamente con la carga parasitaria, a menor carga, mayor resistencia del hospedador quien expresa así su capacidad inmunológica para defenderse del parásito. La intensidad y abundancia medias se encuentran entre los parámetros más usados para cuantificar las cargas parasitarias21. Se ha propuesto estimar al daño causado por el parásito como la pérdida de aptitud biológica del hospedador a medida que aumenta la intensidad de la infección; si esta pérdida fuera nula significaría que el hospedador tolera cargas parasitarias altas sin afectar su aptitud20,13.
Es difícil evaluar la resistencia y la tolerancia en animales de interés económico como resultado de un proceso co-evolutivo entre hospedadores y huéspedes (patógenos). Las líneas y cepas de animales de laboratorio criadas durante un número elevado de generaciones sin haber sido desparasitadas pueden constituirse en modelos experimentales.
Los nematodos oxyuridos son parásitos frecuentes de ratones. En particular Syphacia obvelata vive al estado adulto en el ciego de Mus músculus y su ciclo biológico es directo. La transmisión se da por la ingestión de los huevos embrionados o sus larvas, los que se encuentran adheridos a la piel de la región perianal. También es posible que los animales se infecten por retroinfección anal de sus larvas19.
En el Bioterio de la Facultad de Ciencias Veterinarias - UNR, se fundaron y crían una población testigo de ratones (Mus musculus) derivada de la cepa CF1 (t), y dos pares de líneas de selección divergente para peso corporal15. En estas líneas, con más de 68 generaciones de selección, se propuso comprobar la presencia de nematodos oxiuridos y compararlas en cuanto a la resistencia y tolerancia a estos parásitos.
Materiales y Métodos
Líneas experimentales de ratones
A partir de una población testigo de ratones derivada de la cepa CF1 (t) de la Facultad de Cs Veterinarias-UNR, endocriadas por limitación del número (Ne≤40) y sin selección de los reproductores, se eligieron al azar los fundadores de dos pares de líneas de selección divergente para peso a los 49 días de edad (s' y h': líneas seleccionadas para alto peso, s y h: líneas seleccionadas para bajo peso). El tamaño efectivo se calculó como el promedio de: Neg=(4xNmgxNfg)/(Nmg+Nfg), donde Nmg y Nfg corresponden al número de machos y de hembras de la generación g que dejaron descendientes en la generación g+115.
Actualmente, se continúa con la selección fenotípica, se seleccionan como reproductores los animales más pesados en s’ y h', y los más livianos en s y h. Después de más de 68 generaciones de selección, los promedios de los pesos de las líneas de selección positiva son ~70% más altos que los de las líneas seleccionadas negativamente.
Al destete, los animales se identifican, se separan por sexo y se alojan en número de seis por caja de polipropileno de 28x19x13,5 cm, con cama de viruta. Se les suministra un alimento balanceado comercial con 24% de proteínas (GEPSA Feeds) y agua ad-libitum. Se controla la temperatura ambiente, la renovación del aire y el ciclo de iluminación. El manejo y cuidado de los animales se lleva a cabo según normas éticas reconocidas internacionalmente12.
Los animales no se infestaron artificialmente y durante las generaciones transcurridas no se realizó una desparasitación sistematizada, por ello los ratones estuvieron naturalmente infectados por los oxiuridos22.
Extracción de muestras y recuento del número de huevos
A los 49 días de edad, se muestrearon 175 machos y 187 hembras. Las muestras se tomaron mediante la adhesión de una cinta engomada en la región perianal9, se fijaron en portaobjetos y se leyeron a microscopio óptico para contar el número de huevos de oxiuros por animal.
Estimaciones y análisis estadísticos realizados
Se estimaron los promedios y errores estándar del peso a los 49 días (P), por línea y sexo. Se probó si existían diferencias entre los pesos medios de las cinco líneas, dentro de cada sexo, mediante ANOVA y pruebas de Tukey-Kramer.
Debido a la asimetría de la distribución del número de huevos por gramo (H/P) y a que no existe un estimador de la carga parasitaria que sea el más conveniente21, se estimaron en primer lugar los estadísticos descriptivos usuales para este tipo de variables: medianas (MNA), mínimos y máximos de H/P. Mediante pruebas de Kruskal-Wallis se probó si existían diferencias entre las líneas para las medianas de H/P.
Luego se estimaron los siguientes parámetros parasitológicos de resistencia: - prevalencia (PREV) = número de hospedadores infectados / número de hospedadores examinados4. - intensidad media de H/P (INT) = promedio del número de huevos de parásitos por hospedador infectado21 - abundancia media de H/P (AB) = promedio del número de huevos de parásitos por hospedador examinado21.
Finalmente, se probó si las MNA, INT y AB estimaban la misma carga parasitaria central mediante el cálculo de los coeficientes de correlación de Pearson (rMna-INT, rMna-AB), por sexo. Para estimar la tolerancia, se usó el peso como indicador de la aptitud biológica del huésped. Se supuso que los oxiuros no afectan el crecimiento y desarrollo de estos animales si el peso a la madurez no varía con el incremento de la carga parasitaria medida como número de huevos (H). De esta manera, la pendiente de la regresión lineal del P en H fue el estimador de la tolerancia utilizado. Mediante un análisis de la covariancia se compararon las pendientes de las cinco líneas para probar si existían diferencias significativas entre las tolerancias de las líneas20. Se planteó el siguiente modelo: Pij = μ + αj + βj * Hij + eij; donde Pij corresponde al peso del i-ésimo animal de la línea j, μ: es la media general, αj: es el efecto de la línea j, βj: es la pendiente de la regresión de P en H para la línea j o tolerancia de la línea j, eij es el error aleatorio.
Para todas las pruebas, las diferencias se consideraron significativas si p<0,05. Los análisis estadísticos se realizaron utilizando el programa JMP en su versión 5.0 para Windows (JMP®, SAS Institute, 2003).
Identificación de parásitos adultos
Se sacrificaron 8 ratones adultos (2s, 2s', 2t y 2h'), con más de 49 días de edad, mediante eutanasia con CO21, con protocolo aprobado por el CICUAL de la Facultad de Ciencias Veterinarias - UNR. Se retiraron el ciego y el colon y se abrieron longitudinalmente en una placa de Petri con solución salina al 0,85%. Se contaron e identificaron los vermes11,16,18 en una alícuota del 10% del contenido de cada placa.
Resultados
En ambos sexos, los pesos medios de las líneas se ordenaron según el sentido de la selección practicada, los de las líneas seleccionadas para alto peso difirieron significativamente de los de las líneas seleccionadas para bajo peso, manteniendo la línea testigo pesos intermedios (Tablas I y II).
Tabla I. Peso y número de huevos por gramo por línea. Hembras.

Tabla II. Peso y número de huevos por gramo por línea. Machos.
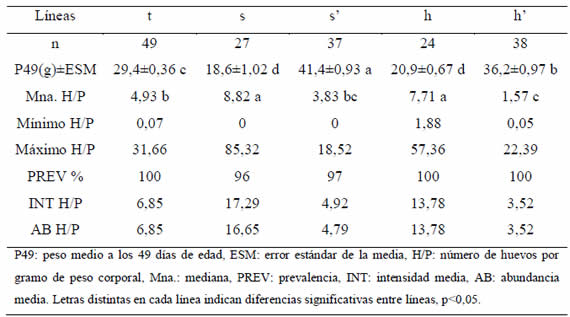
En hembras, los valores de las PREV de las líneas t, s' y h' se correspondieron con 8, 2 y 18 individuos no infectados, respectivamente (Tabla I). Todos los machos observados estuvieron infectados, a excepción de un s y un s', por lo cual, las PREV son mayores a 0,97 para todas las líneas (Tabla II). Las medianas, rangos y máximos de H/P fueron menores en las hembras con respecto a los machos en todas las líneas. Al comparar las medianas de H/P, se observó que las líneas de selección negativa de peso presentaron las mayores cargas parasitarias y h' los valores medianos más bajos, diferenciándose de la otra línea seleccionada para alto peso (s'). Las líneas h' y s' fueron las menos variables en cuanto al número de huevos por gramo (Tablas I y II). Los valores de INT y AB ordenaron a las líneas en forma similar al orden establecido por las medianas (Tablas I y II). Las correlaciones entre INT y AB y las medianas fueron todas mayores a 0,97 y significativas (p<0,05). El modelo utilizado para el análisis de la covariancia explicó el 78% y 76% de la variabilidad del peso en hembras y machos, respectivamente, atribuible a las diferencias entre líneas (Fig. 1 y 2). En ambos sexos, las pendientes de P en H fueron no significativas para todas las líneas, es decir, las cargas parasitarias no afectaron el peso a la madurez de los animales de estas líneas.
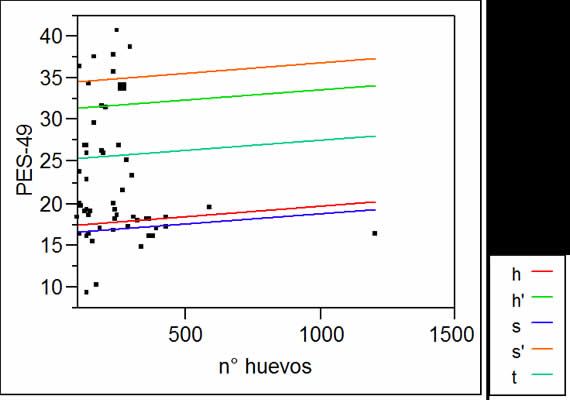
Figura I. Regresión del peso en las cargas parasitarias por línea. Hembras.
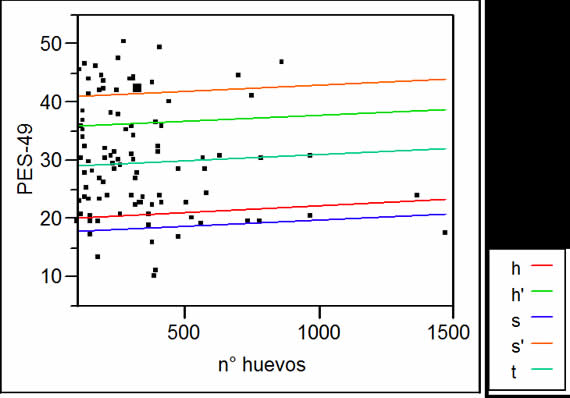
Figura II. Regresión del peso en las cargas parasitarias por línea. Machos.
Los vermes identificados en ocho machos adultos correspondieron a las especies Syphacia obvelata (Rudolphi, 1802) y Aspiculuris tetraptera (Nitzch, 1821). En total, se encontraron 4.019 S. obvelata y 2.950 A. tetraptera. La presencia de estos nematodes, como únicas especies de helmintos presentes en la colonia, fue monitoreada por diagnóstico coproparasitológico ocasionalmente desde el comienzo de la selección.
Discusión
Los animales pertenecientes a las líneas de esta colonia estaban mayoritariamente infectados con oxiuros (S. obvelata y A. tetraptera) como lo demuestran los valores de las prevalencias, a excepción de las hembras de la línea h'. Estas especies son frecuentes en ratones experimentales mantenidos en bioterios convencionales de diversos países3,6.
Tradicionalmente la presencia de oxiuros se diagnostica con el animal vivo mediante la detección de huevos por adhesión de una cinta transparente engomada en la zona perianal y la observación de la materia fecal, método utilizado en el presente trabajo. Sin embargo, no hay consenso sobre cuál es la mejor técnica a utilizar6,8,10. La variabilidad de los resultados obtenidos con diferentes técnicas estaría relacionada con las diferencias en la biología de los parásitos. La edad, sexo y cepa de los animales juegan un papel fundamental en la prevalencia y grado de infección de estas parasitosis.
En nuestro estudio, la técnica de la cinta engomada tuvo una alta sensibilidad para detectar los animales infectados debido a los altos valores de las prevalencias. Lo mismo puede decirse sobre del conteo del número de huevos dado que, en ambos sexos, coincide el ordenamiento de las líneas en cuanto a las cargas parasitarias.
Otra cuestión técnica que es objeto de debate, como se ha mencionado, es cuál indicador utilizar como medida cuantitativa de la carga parasitaria para una población o rodeo, y cómo interpretarlo4,21. En este trabajo, se optó por estimar parámetros estadísticos de tendencia central y de dispersión para variables distribuidas asimétricamente, luego parámetros parasitológicos y correlacionar ambos. Las medianas, intensidades y abundancias medias demostraron ser estimadores de la misma carga parasitaria central de cada línea, como lo indicaron los altos y significativos valores de las correlaciones entre ellas.
Las líneas seleccionadas se diferenciaron en su resistencia frente al parásito. Los resultados parecerían indicar una relación inversa entre las cargas parasitarias y la selección de peso. Es decir, que a mayor carga de oxiuros menor sería el peso de los animales. Sin embargo, al estimar la tolerancia de las líneas se pudo observar que las cargas parasitarias no producen una disminución de los pesos, es decir, que las líneas muestran tolerancia para este componente de la aptitud biológica dentro de los rangos de las cargas parasitarias encontrados de S. obvelata y A. tetraptera.
La infección por S. obvelata y A. tetraptera en animales inmunocompetentes es generalmente silenciosa, algunos estudios han descripto prolapso rectal, poco pelo, enteritis, pérdida de peso, prurito (Charles River - Technical Sheet https://www.criver.com/). Los animales de estas líneas no presentaron estos síntomas.
El hombre y el ratón comparten el 99% de sus genes. El ratón es el modelo más usado para estudiar las bases genéticas, moleculares y celulares de las enfermedades humanas y de los procesos biológicos normales17; entre ellos, la resistencia/susceptibilidad a las infestaciones con nematodos intestinales2,5,7,22. La resistencia-susceptibilidad es un carácter complejo, cuya base genética se ha evidenciado en modelos murinos para distintas especies de patógenos14,22. Estas líneas no fueron infestadas artificialmente. Se evaluó el resultado de la co-evolución ratón-parásito luego de más de 68 generaciones de selección del hospedador. Durante este proceso, el hospedador cambió su genotipo como lo demuestra la respuesta obtenida a la selección de peso. La co-evolución hospedador-parásito y la evolución de las líneas por la selección de peso han conducido a una diferenciación de las líneas en cuanto a la resistencia adquirida pero no con respecto a la tolerancia. Ésto conduce a intensificar los estudios en relación a la base genética de la resistencia diferenciada de las líneas, principalmente de h'.
1. American Veterinary Medical Association. AVMA Guidelines on Euthanasia Formerly Report. Panel on Euthanasia. 2013. En: https://www.avma.org/KB/Policies/Documents/euthanasia.pdf. Última consulta: 20/08/2018.
2. Artis, D. New weapons in the war on worms: Identification of putative mechanisms of immune-mediated expulsion of gastrointestinal nematodes. International Journal for Parasitology. 2006; 36:723-733.
3. Bazzano, T.; Restel, T.I.; Pinto, R.M.; Gomes, D.C. Patterns of Infection with the Nematodes Syphacia Obvelata and Aspiculuris tetraptera in Conventionally Maintained Laboratory Mice. Mem Inst Oswaldo Cruz. 2002; 97(6):847-853.
4. Bush, A.O.; Lafferty, K.D.; Lotz, J.M.; Shostak, A.W. Parasitology Meets Ecology on its Own Terms: Margolis et al. Revisited. J. Parasitol. 1997; 83(4):575-583.
5. De Jesús, R.; Pavón, W. Sinergismo en la respuesta inmune en ratones BALB/c//BIOULA con parasitosis combinadas: Syphacia obvelata y Leishmania mexicana. Spei Domus. 2014; 10(21):29-39.
6. Fuentes, M.; Sánchez Acedo, C.; Quilez, J. Prevalencia y grado de parasitación por Syphacia obvelata y Aspiculuris tetraptera en ratones NMRI, C57Bl/6 y Balb/c. REDVET. 2017; 18(9):1-22.
7. Gause, W.C.; Urban, J.F.; Stadecker, M.J. The immune response to parasitic helminths: insights from murine models. Trends in Immunology. 2003; 24 (5): 269-277.
8. Gerwin, P.M.; Ricart Arbona, R.J.; Riedel, E.R.; Lepherd, M.L.; Henderson, K.S.; Lipman, N.S. Evaluation of Traditional and Contemporary Methods for Detecting Syphacia obvelata and Aspiculuris tetraptera in Laboratory Animals. J. of the American Association for Laboratory Animal Science. 2017; 56(1):32-41.
9. Graham, C.F. Advice for the diagnosis of Enterobius vermicularis. Ann. J. Trop. Med. 1941; (21):159.
10. Hill, W.A; Randolph, M.M.; Mandrell, T.D. Sensitivity of Perianal Tape Impressions to Diagnose Pinworm (Syphacia spp.) Infections in Rats (Rattus norvegicus) and Mice (Mus musculus). J. of the American Association for Laboratory Animal Science. 2009; 48(4):378-380.
11. Hussey, K.L. Syphacia muris vs. S. obvelata in laboratory rats and mice. J. Parasit. 1957; 43:555-559.
12. Institute of Laboratory Animal Research. Guide for the care and use of laboratory animals. National Research Council. 8th ed. National Academy Press, Washington. 2011.
13. Kutzer, M.A.M.; Armitage, S.A.O. Maximising fitness in the face of parasites: a review of host tolerance. Zoology. 2016; 119: 281-289.
14. Longley, R.; Smith, C.; Fortin, A.; et. al. Host resistance to malaria: using mouse models to explore the host response. Mamm. Genome. 2011; 22: 32-42.
15. Oyarzabal, M.I.; Rabasa, S.L. Riqueza genética y estabilidad en ratones de la cepa CF1. Mendeliana. 1999; 13(2):74-84.
16. Parel, J.D.C.; Galula, J.U.; Ooi, H.K. Characterization of rDNA sequences from Syphacia obvelata, Syphacia muris and Aspiculuris tetraptera and development of a PCR-based method for identification. Vet. Parasitol. 2008; 153(3-4):379-83.
17. Peters, L.L.; Robledo, R.F.; Bult, C.J.; Churchill, G.A.; Paigen, B.J.; Svenson, K.L. The mouse as a model for human biology: a resource guide for complex trait analysis. Nature Reviews Genetics. 2007; 8:58-69.
18. Petter, A.J.; Quentin, J.C. Key N° 4. Genera of the Oxyuroidea. In Keys to the Nematode Parasites of Vertebrates. Anderson R. C., Chabaud A. G., Willmott S. Editorial: Centre for Agriculture and Biosciences International CABI, pp 19. 2009.
19. Prince, M. J. R.; Studies on the life cycle of Syphacia obvelata, a common nematode parasite of rats. Science. 1950; 111 (2873): 66-67.
20. Raberg, L.; Graham, A.L.; Read, A.F. Decomposing health: tolerance and resistance to parasites in animals. Phil. Trans. R. Soc. B. 2009; 364: 37-49.
21. Rózsa, L.; Reiczigel, J.; Majoros, G. Quantifying parasites in samples of hosts. J. Parasitol. 2000; 228-232.
22. Vasconi, M.D.; Malfante, P.; Bassi, A.; et al. Phenotypic differences on the outcome of the host-parasite relationship: Behavior of mice of the CBi stock in natural and experimental infections. Veterinary Parasitology. 2008; 154:157-163.