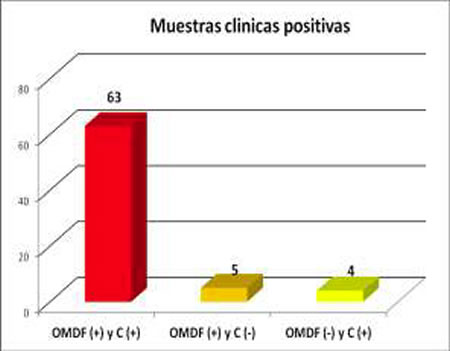
Gráfico 1. Eficacia de las técnicas utilizadas.
ARTÍCULO DE INVESTIGACIÓN
Eficacia de la observación microscópica directa y el cultivo en el diagnóstco de las dermatofitosis en caninos
Reinoso, EH.1; Reynaldi, FJ.1,2; Rosa, DE.1; Della Vedova, R.1; Romero, MC.1,2
1Cátedra de Micología Médica e Industrial “Prof. Dr. Pablo Negroni”. Fac. Cs. Veterinarias (UNLP).
2CCT CONICET La Plata.
Recibido: 01/03/2017
Aceptado: 10/10/2017
Correspondencia e-mail: Reinoso Enso reinosonavarrete@yahoo.com.ar
Resumen
Las Dermatofitosis (tiñas), son micosis superficiales producidas por eumycetos con fuerte actividad queratinofílica, que afectan piel y faneras del hombre y animales. Las mascotas poseen un rol especial, dado que son una de las fuentes más comunes de contagio para el hombre, en particular los niños por su relación estrecha con las mismas.
La forma de confirmar estas enfermedades es a través del diagnóstico micológico, donde el rendimiento (positividad) de los parámetros de laboratorio en las muestras de humanos es mucho mayor en comparación con muestras de origen animal. La confirmación diagnóstica en tiñas del cuero cabelludo de los niños, supera el 90%; mientras en los animales con formas clínicas compatibles con esta micosis, solo un porcentaje menor es confirmada por el laboratorio. Se ha demostrado que los valores máximos de aislamiento de hongos causantes de dermatofitosis en perros son del 36,9 - 40 %.
Nuestro objetivo es determinar el rendimiento de laboratorio en muestras de piel y pelos de caninos con sospecha clínica de micosis superficiales provenientes de la ciudad de La Plata, entre Marzo 2005 y Marzo 2013, usando las técnicas clásicas de observación microscópica directa en fresco y cultivo.
Palabras clave: Observación microscópica; Cultivo; Dermatofitosis; Caninos.
Effectiveness of direct microscopic observation and cultive for the diagnosis of canine dermatophytes
Summary
Dermatophytosis (ringworm) are superficial mycosis produced by molds with strong keratinophilic activity, affecting skin of humans and animals. Pets have a special role, because they are one of the most common sources of infection for men, particularly children because of their close relationship with them.
The confirmation of these diseases is through mycology laboratory diagnosis, where the performance (positivity) of laboratory parameters in human samples is much higher compare to samples of animal origin. Diagnostic confirmation in ringworm of children exceeds 90%; while in animals with compatible clinical forms of this mycosis, only a minor percentage is confirm by the laboratory. The maximum isolation values of fungi that cause dermatophytosis in dogs are 36.9 - 40%.
Our objective is to determine the laboratory performance in samples of skin and hair of canines with clinical suspicion of superficial mycoses from the City of La Plata, between March 2005 and March 2013, using the classic techniques of direct microscopic observation and culture.
Key words: Microscopic observation; Culture; Dermatophytosis; Canine.
Introducción
Las Dermatofitosis vulgarmente conocida como tiñas, son micosis superficiales producidas por eumycetos con fuerte actividad queratinofílica, que afectan la piel y faneras del hombre y animales. En los caninos es una de las micosis superficiales más reportadas por diferentes autores; siendo su agente etiológico más frecuente Microsporum canis5,13,19; que también se comporta como un importante agente etiológico en las tiñas de los felinos2,14. Otros dermatofitos como Microsporum gypseum, cuyo habitat es el suelo, Trichophyton mentagrophytes vinculado a conejos, ratas y cobayos y T. verrucosum en bovinos, también son responsables de micosis superficiales en los perros. Estas mascotas poseen un rol especial, dado que son una de las fuentes más comunes de contagio para el hombre, en particular los niños; que a su vez origina, una de las consultas más frecuentes en Dermatología médica humana8,10, 17.
Se describe que en el 70 % de los hogares donde existe un perro o gato enfermo, al menos una persona presentará una dermatofitosis12. Numerosos trabajos de divulgación y/o investigación confirman a los animales como fuente común de infección, comportándose como reservorios o portadores sanos de los agentes causales; lo que conlleva al contagio entre animales y de estos al hombre. En este sentido, las mascotas tienen un rol fundamental, ya que son la fuente de infección entre el 83 – 85,2 % de los casos humanos8, 11.
La forma de confirmar esta infección es a través del laboratorio de micología donde el rendimiento (positividad) de los parámetros de laboratorio en las muestras de seres humanos es mucho mayor en comparación con muestras de origen animal. Así, Reinoso y colaboradores (2005) procesaron 185 muestras de tiñas del cuero cabelludo de niños, de la ciudad de La Plata y sus alrededores, identificando a M. canis en el 98,90% de los aislamientos; en este caso, el rendimiento de los métodos de Laboratorio convencionales como observación microscópica directa en fresco (OMDF) (+) positiva y Cultivo (C) (+) positivo, fue del 94.45 %. Sin embargo, en los animales con formas clínicas compatibles con dermatofitosis, solo un porcentaje menor es confirmada por el laboratorio. En este aspecto algunos autores han demostrado que los valores máximos de aislamiento de hongos causantes de dermatofitosis en perros es del 36,9 - 40 % 3.
Objetivo
Determinar la eficacia de la observación microscópica directa en fresco y el cultivo en muestras de piel y pelos de caninos, con sospecha clínica de dermatofitosis, provenientes de la Ciudad de La Plata, entre Marzo 2005 y Marzo 2013.
Materiales y Métodos
Se procesaron 321 muestras de piel y pelos de caninos de 1 mes a 14 años de edad. El 50,5% fueron machos y 49,5% hembras. Las razas con mayor consulta fueron mestizos (29.2%), Yorkshire (9%). Las muestras se obtuvieron por raspado con bisturí estéril, rasurando el borde interno de las lesiones y tomando pelos rotos de 2-3 mm de largo con pinzas de depilar estériles.
Las muestras fueron sometidas a OMDF previo tratamiento con (HO)K al 40% en caliente o Lactofenol de Amman y cultivo en Agar glucosado de Sabouraud (AGS) 4%, adicionado de extracto de levadura (1%); Cloranfenicol (500 mg/L) y Cicloheximida (500 mg/L) en pico de flauta, en tubos de borosilicato de 17 x 170 mm de diámetro. Se incubaron a 25-28ºC entre 15 y 25 días.
La identificación de las cepas se basó en los métodos y técnicas propuestas por Harris (1986) y Scott y colaboradores (2002), que basan su identificación en aspectos macromicromorfológicos y fisiológicos de los agentes etiológicos aislados.
Resultados
La confirmación diagnóstica fue en 72 animales (22,43%). De las muestras positivas, el 87,50% (63 casos) presentó una OMDF (+) y cultivo C (+); el 6,90% de las muestras (5 casos) presentó una OMDF (+) con C (-) y el 5,60% de las muestras (4 casos) OMDF (-) con C (+) (Figura 1). Microsporum canis se aisló en 39 casos (58,20%) y M. gypseum en 28 animales (41,80%).

Gráfico 1. Eficacia de las técnicas utilizadas.
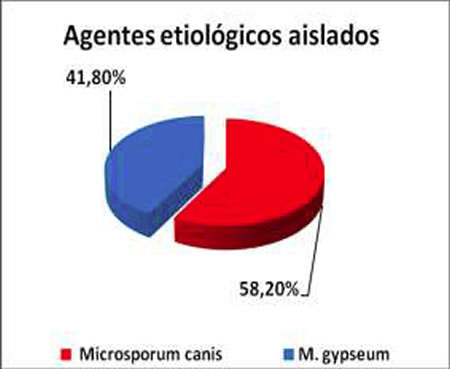
Gráfico 2: Agentes etológicos recuperados en cultivos.
Discusión
Nuestros resultados muestran la escasa confirmación diagnóstica del laboratorio ante la sospecha clínica de Dermatofitosis en caninos (22,43%) y, son comparables con los resultados de Mancianti y col. (2003) 21,80% (Italia), Garcia & Blanco (2000) 18,00% (España), Reinoso y col. (2006) 29% (Argentina), y Cabañez y col (1997) 33,90% (España). Esto podría estar vinculado a una sobreestimación clínica de esta micosis, según Moriello y col. (1995). Las muestras positivas presentaron una correlación entre OMDF (+) y C (+) alta (87,50%), lo que permitió confirmar un diagnóstico certero. Por otro lado, el 12,50% de las muestras fue positivo por solo una de las técnicas utilizadas. Sin embargo, el 5,60% de las muestras con OMDF (-) y C (+) podría ser interpretado que estos animales se comportan como portadores sanos, ya que en la OMDF no se observaron pelos parasitados. Resultados similares fueron informados por Silva y col. (2003) 5,00% y Mantovani y col. (1997) 8,10% y Ates y col. (2009) que menciona 2,60% de caninos portadores sanos, aunque no aisló a M. canis.
El aislamiento de M. gypseum en nuestro estudio (41,80%), es muy alto comparado con otros autores como Mancianti y col. (2003) 2,20%, Garcia & Blanco (2000) 2,00%, Silva y col. (2003) 6,80% y Segundo y col. (2004) 4,34%. Una posible explicación del porcentaje de tiñas en caninos por M. gypseum, estaría vinculado con el elevado número de aislamientos de esta especie a partir de muestras de suelo de nuestra región7; comportándose el mismo, como fuente común de infección.
Finalmente, cabe destacar que la escasa confirmación diagnóstica del laboratorio estaría relacionada a que los signos y síntomas de esta micosis son comunes a otras dermatopatías. Esta particularidad hace fundamental el rol del Laboratorio en la confirmación diagnóstica de las dermatofitosis en caninos.
1. Ates A, Iikit M, Ozdemir R and Ozcan. Dermatofhytes isolated from asymptomatic dogs in Aldana, Turkey: A Preliminary Study. J Micol Med.2009; 18: 154-158.
2. Cabañes FJ, Abarca ML, Bragulat MR. Dermatophytes isolated from domestic animals in Barcelona, Spain. Mycopathol.1997; 137: 107-113.
3. Caretta, G., Mancianti, F. and Ajello, L. Dermatophytes and Keratinophilic Fungi in Cats and Dogs Dermatophyten und keratinophile Pilze bei Katzen und Hunden. Mycoses. 1989. 32: 620–626.
4. Garcia M, Blanco J. Principales enfermedades fúngicas que afectan los animales domésticos. Rev. Iberoam. Micol. 2000; 17:2-7.
5. Guzman-Chavez RE, Segundo-Zaragoza C, Cervantes-Olivares RA, Tapia-Perez G. Presence of keratinophilic fungi with special reference to dermatophytes on the haircoat of dogs and cats in México and Nezahualcoyotl cities. Rev Latinoam Microbiol. 2000. 42(1):41-4.
6. Harris JL. Modified method for fungal slide culture. J Clin Microbiol 1986; 24:460-461.
7. Iovannitti C.A., Malliarchuk A., Casanova M., Dawson M. Estudio Micológico de tierra de la Ciudad de La Plata. Rev. Arg. Micología, 1985. 8 (1):9-11.
8. Lynch, P., Finquelevich, J., Etchepare, P., Tinea capitis: estudio epidemiológico en el Hospital Municipal Materno Infantil de San Isidro “Dr. C. Gianantonio” (período abril de 2000 a marzo de 2002). Dermatol. Pediatr. Lat. Enero- abril 2005; .3 Nº1: 39-43.
9. Mancianti F, Nardoni S, Corazza M, Achille P and Ponticelli C. Environmental detection of Microsporum canis arthosporas in the households of infected cats and dogs. J. Fel Med Surg 2003; 5:323-8.
10. Mantovani A, Morganti L. Dermatophyto-zoonoses in Italy. Vet. Sci. Comm. 1997; 1: 171-177.
11. Mayorga, J, Espinoza R, Villarreal I, García A. Tiña de la cabeza. Observaciones clínico-micológicas en 30 pacientes. Dermatología Rev. Mex. 1999; 43: 264-267.
12. Moriello kA, Deboer DJ: Feline dermatophytoses. Recent advances and recomendatio for terapy. Vet. Clin. North. Am: Amall an Pract, 1995; 25:901-921.
13. Nweze E.I. Dermatophytoses in domesticated animals. Rev. Inst. Med. Trop. Sao Paulo. 2011. 53(2):95-99
14. Oliveira V, Alvez C, Pereira M, Cardenes K, Ocurrencia de Microsporun canis em felines sadios atendidos no hospital veterinario da unidade 3 da faculdade anahanguera de campinas. Anuara da producao de iniciacao científica discente. 2010; vol 13; N°16.
15. Reinoso E.H., Reynaldi F.J., Pestana L.M. y Rosa D.E. Rendimiento de los métodos de laboratorio convencionales en el diagnóstico de micosis superficiales humanas. Actas X Congreso Argentino de Micología y XX Jornadas Argentinas de Micología, CABA. 2005.
16. Reinoso EH., Bartoletti L., Vasallo M., Pestana L., Aicardi L. Tiña capitis (Dermatofitosis) en niños de la ciudad de La Plata. Actas I Congreso Panamericano de Zoonosis. V Congreso Argentino de Zoonosis. II Congreso Bonaerense de Zoonosis. La Plata. Argentina. 2006.
17. Santos PE, Córdoba SB, Rodero LL, Carrillo-Muñoz AJ y Lopardo HA. Tinea capitis. Experiencia de 2 años en un hospital de pediatría de Buenos Aires, Argentina. Rev. Iberoam. Micol. 2010; 27(2):104– 106.
18. Scott, D. W.; Miller, W. H.; Griffin, C. E. “Dermatología en pequeños animales”. Ed. Intermédica. 2002.
19. Segundo C., Martínez A-, Arenas R., Fernández R. y Cervantes RA. Dermatomicosis por Microsporum canis en humanos y animales. Rev. Iberoam. Micol. 2004; 21: 39-41
20. Silva V, Thomson P, Maler l, Anticevic S. Infección y colonización por dermatofitos en cánidos del área sur de Santiago de Chile. Rev. Iberoam. Micol. 2003; 20:145-8.